概述
為了更好的研究化學反應,在生產、生活、科研中,人們將化學進行分類。分類的主要依據是化學反應的基本特徵。常見的四種基本化學反應類型有化合反應、分解反應、置換反應、複分解反應。表達式
分解反應,是化學反應的常見類型之一,是化合反應的逆反應。它是指一種化合物在特定條件下(如加熱、通直流電、催化劑等)分解成二種或二種以上較簡單的單質或化合物的反應。
形如A=B+C 或 A=B+C+D
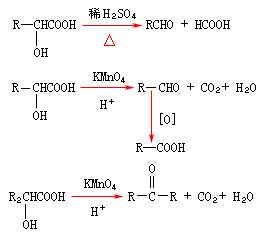
一般規律
比較不穩定的物質,通過分解反應,生成比較穩定的物質。
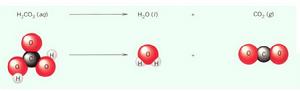 汽水中的分解反應
汽水中的分解反應反應類型
按產物種類多少分類:
一、加熱分解的產物有兩種
1.分解成兩種單質
(1)氣態氫化物的分解
碘化氫的分解 2HI=H2+I2
(2)鹵化銀的分解
氯化銀的分解 2AgCl=2Ag+Cl2↑
(3)電解
電解水 2H2O=(通電)2H2↑+O2↑
2.分解成兩種化合物
(1)不穩定鹽類的分解
碳酸鈣的高溫分解 CaCO3=(高溫)CaO+CO2↑
(2)不穩定弱鹼的分解
氫氧化鋁受熱分解 2Al(OH)3=Al2O3+3H2O
(3)不穩定弱酸的分解
碳酸的分解 H2CO3=(△)H2O+CO2↑
(4)含結晶水的鹽類的脫水
十水碳酸鈉的風化 Na2CO3.10H2O=Na2CO3+10H2O
3.分解成一種單質和一種化合物
(1)不太穩定的鹽類的分解
氯酸鉀的催化分解 2KClO3(MnO2)===(△)2KCl+3O2↑
(2)不穩定酸的分解
次氯酸的分解 2HClO=2HCl+O2
 分解反應
分解反應(3)雙氧水的分解
受熱分解 2H2O2=2H2O+O2
4.有機物的分解
甲烷的裂解 2CH4=C2H2+3H2
二、加熱分解的產物有三種
1.不穩定鹽類的分解
碳酸氫鈉受熱分解 2NaHCO3=Na2CO3+CO2↑+H2O
(2)亞硫酸的酸式強鹼鹽受熱分解
亞硫酸氫鈉受熱分解 2NaHSO3=Na2SO4+SO2↑+H2O
(3)銨鹽的受熱分解
碳酸銨受熱分解 (nh4)2co3=2NH3↑+H2O↑+CO2↑
(4)高錳酸鉀受熱分解 2KMnO4加熱=K2MnO4+MnO2+O2↑
(5)硝酸鹽的受熱分解
硝酸銀的受熱分解 2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
受熱分解 4HNO3=4NO2+O2+2H2O
3.電解水溶液
(1)電解飽和食鹽水 2NaCl+2H2O=2NaOH+H2+Cl2
按反應物種類進行分類:
1.酸的分解反應。
(1)含氧酸=非金屬氧化物+水
如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
(2)某些含氧酸的分解比較特殊,
如硝酸的分解:
4HNO3(濃)=4NO2↑+O2↑+2H2O,
次氯酸分解
2HClO=2HCl+O2↑
2.鹼的分解反應。
活潑金屬的氫氧化物較難分解,難溶性鹼一般都較易分解:
如 2Al(OH)3=Al2O3+3H2O,2Fe(OH)3=Fe2O3+3H2O,Cu(OH)2=CuO十2H2O。
3.鹽的分解反應。
碳酸鹽、硝酸鹽、銨鹽一般都較易分解,且反應表現出一定的規律性。
(1)碳酸鹽的分解。碳酸鹽=金屬氧化物十CO2↑
如CaCO3=CaO+CO2↑,CuCO3=CuO+CO2↑
K2CO3、Na2CO3比較穩定,很難分解,而其酸式鹽較易分解:
 分解反應
分解反應2NaHCO3=Na2CO3+CO2↑+H2O
(2)硝酸鹽的分解反應。硝酸鹽受熱均易分解,並放出氧氣,其規律大體如下:
活動性強的金屬(K、Ca、Na)硝酸鹽=亞硝酸鹽十O2↑:
如2KNO3=2KNO2+O2↑。
處於活動性順序表中間的金屬(Mg、Cu等)的硝酸鹽=金屬氧化物十NO2↑十O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑
2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活動金屬(Hg、Ag、Au)的硝酸鹽=金屬十NO2↑+O2↑:
如Hg(NO3)2=Hg十2NO2↑十O2↑
2AgNO3=2Ag+2NO2↑+O2↑
(3)銨鹽的分解反應。銨鹽受熱易分解,一般都有氨氣放出:
如(NH4)2SO4=2NH3↑+H2SO4
NH4HCO3=NH3↑+CO2↑+H2O。
(4)其它鹽類的分解反應
如2KClO3=2KCl+3O2↑
2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反應。
非金屬氧化物一般不容易發生分解反應
2H2O2=H2↑+O2↑
金屬氧化物一般分解的規律是:
金屬活動順序表中,排在銅後的金屬氧化物受熱易分解:
如2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活潑的金屬氧化物,給它們熔化態通電流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑

