簡介
物質由分子組成,分子由原子構成,除稀有氣體外,都不是單原子狀態存在,而是以原子相互結合成分子或晶體的形式存在。物質的化學性質主要取決於分子的內部結構,為了更好地掌握物質的性質及其化學變化規律,有必要在研究原子結構的基礎上討論化學鍵和分子結構。
分子結構:
①分子的組成:指構成分子的原子種類和數目。
②分子的空間構型:指分子的空間幾何形狀,包括分子內部原了的連線次序、空間排布、鍵角、鍵長及分子大小等。
③化學鍵:分子或晶體中原子、離子之間的強烈相互作用 。
晶體的特徵
晶體:具有規則幾何外形的固體。
晶體的特點:微觀粒子排列的周期性點陣、晶格。
晶胞:能表現晶體一切特徵的最小單位
晶體的特徵:
(1)有固定幾何形狀
(2)有固定熔點
(3)各向異性
(4)能產生X—衍射圖
三種離子晶體
離子晶體的晶格結點上交替地排列著正離子和負離子,正負離子間靠離子鍵結合。在離子晶體中,正負離子按一定的配位數在空間排列著。這種排列情況是多種多樣的,常見的AB型離子晶體的結構類型有三種:NaCl型、CsCl型及ZnS型(見圖2-4)。
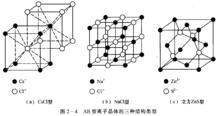 圖2-4
圖2-4由於正負離子間的靜電作用力較強,所以離子晶體一般具有較高的熔點及沸點。由庫侖定律可知,離子所帶的電荷越高,離子半徑越小,靜電作用力也就越大,離子晶體的熔點及沸點也就越高 。
晶格能
不同類型的晶體組成和構型不同,其熔點、沸點、硬度及熱穩定性不同。晶體的這些性質與晶格微粒間作用力的大小有關。這種作用力,可以用晶格能來衡量。
對於離子晶體,晶格能定義為:在標準狀態下,從相互遠離的正負氣態離子結合成1mol離子晶體時所釋放出的能量,用U表示。用波恩-哈伯循環法測量 。
本質和類型
瞬時偶極
靠近的兩分子間由於同極相斥異極相吸,瞬時偶極間總是處於異極相鄰的狀態。我們把瞬時偶極間產生的分子間力叫做色散力。雖然瞬時偶極存在的時間極短,但偶極異極相鄰的狀態總是不斷地重複著,所以任何分子(不論極性與否)相互靠近時,都存在著色散力。同族元素單質及其化合物,隨分子量的增加,分子體積越大,瞬時偶極矩也越大,色散力越大。
極性分子受極性分子電場的作用,原來重合的正、負電荷中心分離開來產生誘導偶極。誘導偶極與極性分子固有偶極間的作用力叫做誘導力。
固有偶極
極性分子本身正負電荷中心不重合而具有的偶極稱為固有偶極。當極性分子相互靠近時,它們的固有偶極間相互作用,兩個分子在空間按照異極相鄰的狀態取向。由於固有偶極的取向而引起的分子間的力叫做取向力。取向後,極性分子更加靠近,相互誘導,使正、負電荷中心更加分開,產生誘導偶極,因而它們之間存在誘導力。此外也存在著色散力。
在非極性分子間只存在著色散力;極性分子與非極性分子間存在著誘導力和色散力;極性分子間既存在著取向力,還有誘導力和色散力。(所有分子間都存在色散力)分子間力就是這三種力的總稱。
分子間力永遠存在於一切分子之間,是相互吸引作用,無方向性,無飽和性,強度比化學鍵小1~2個數量級,和分子間距離的7次方成反比,並隨分子間距離的增大而迅速減小,通常作用範圍在 5*10以內。大多數分子,其分子間力是以色散力為主;只有極性很強的分子(如水分子)才是以取向力為主。
分子晶體
凡靠分子間力(有時還可能有氫鍵)結合而成的晶體統稱為分子晶體。分子晶體中晶格結點上排列的是分子(也包括像稀有氣體那樣的單原子分子)。乾冰(固體CO)就是一種典型的分子晶體。由於分子間力比離子鍵、共價鍵要弱得多,所以分子晶體物質一般熔點低、硬度小、易揮發。
分子晶體氫鍵
稀有氣體、大多數非金屬單質(如氫氣、氮氣、氧氣、鹵素單質、磷、硫磺等)和非金屬之間的化合物(如HCl,CO等),以及大部分有機化合物,在固態時都是分子晶體。
有一些分子晶體物質,分子之間除了存在著分子間力外,還同時存在著更為重要的氫鍵作用力,例如冰、草酸、硼酸、間苯二酚等均屬於氫鍵型分子晶體 。
離子極化作用
離子
當單個離子在外電場的作用下,由於離子中的核和電子發生了相對位移,也會產生誘導偶極。離子在外電場作用下產生誘導偶極的過程叫做離子的極化。
離子被極化的結果,使離子的外層電子云發生變形。離子的變形性大小用極化率來表示。
在離子晶體中,每個離子都具有電荷,每個離子對另外的相鄰離子來說都是外電場,故正負離子間發生相互極化。正離子主要表現極化力,只有當正離子最外層為18電子時,正離子的極化率才比較顯著。
正離子主要表現為極化力(即:使其它離子變形的能力),其強弱主要決定於:
① 離子的大小,r越小,極化力越強。
② 離子電荷多少,電荷越多,極化力越強。
③ 當r相近,電荷相等時(如Na和Ag)。則極化力主要取決於外層電子數的多少,即取決於離子類型。
負離子主要表現為變形性,變形性的大小決定於:
① 離子半徑:半徑越大,極化率(變形性)越大,負離子的極化率一般比正離子大。
② 當半徑相近時,決定於離子的外層電子結構。
影響
正負離子相互極化,由於正、負離子相互極化的結果,使陽離子和陰離子之間發生了額外的吸引力,導致正、負離子核間距縮短,正、負離子外層電子云密度增大,鍵的極性減弱,因而使離子鍵過渡到共價鍵。
影響
前面講過,離子晶格的類型和晶體的配位數以及正、負離子的半徑比有關,但是常常許多離子晶體的離子半徑比符合於某一類型的晶體結構,而實際上卻呈現出另一類型的晶體結構,這也可以用離子的極化來說明。
離子極化導致鍵型的過渡,相應地也產生晶體類型的過渡,這種在同一周期內化合物的晶型變化中體現出來。例如第三周期元素最高價態的氧化物 。