發展歷程
 德米特里·伊萬諾維奇·門捷列夫
德米特里·伊萬諾維奇·門捷列夫 現代化學的元素周期律是1869年俄國科學家門捷列夫(Dmitri Mendeleev)首先創造的,他將當時已知的63種元素依相對原子質量大小並以表的形式排列,把有相似化學性質的元素放在同一列,製成元素周期表的雛形。經過多年修訂後才成為當代的周期表。在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一橫行稱為一個周期,一列稱為一個族。
原子半徑由左到右依次減小,上到下依次增大。
在化學教科書和字典中,都附有一張“元素周期表(英文:the periodic table)”。這張表揭示了物質世界的秘密,把一些看來似乎互不相關的元素統一起來,組成了一個完整的自然體系。它的發明,是近代化學史上的一個創舉,對於促進化學的發展,起了巨大的作用。看到這張表,人們便會想到它的最早發明者——門捷列夫。1869年,俄國化學家門捷列夫按照相對原子質量由小到大排列,將化學性質相似的元素放在同一縱行,編制出第一張元素周期表。元素周期表揭示了化學元素之間的內在聯繫,使其構成了一個完整的體系,成為化學發展史上的重要里程碑之一。隨著科學的發展,元素周期表中未知元素留下的空位先後被填滿。當原子結構的奧秘被發現時,編排依據由相對原子質量改為原子的質子數﹙核外電子數或核電荷數﹚,形成現行的元素周期表。
按照元素在周期表中的順序給元素編號,得到原子序數。原子序數跟元素的原子結構有如下關係:
質子數=原子序數=核外電子數=核電荷數
 元素周期表
元素周期表 利用周期表,門捷列夫成功的預測當時尚未發現的元素的特性(鎵、鈧、鍺)。1913年英國科學家莫色勒利用陰極射線撞擊金屬產生射線X,發現原子序越大,X射線的頻率就越高,因此他認為核的正電荷決定了元素的化學性質,並把元素依照核內正電荷(即質子數或原子序)排列。後來又經過多名科學家多年的修訂才形成當代的周期表。 將元素按照相對原子質量由小到大依次排列,並將化學性質相似的元素放在一個縱列。每一種元素都有一個序號,大小恰好等於該元素原子的核內質子數,這個序號稱為原子序數。在周期表中,元素是以元素的原子序排列,最小的排行最前。表中一橫行稱為一個周期,一列稱為一個族。
原子的核外電子排布和性質有明顯的規律性,科學家們是按原子序數遞增排列,將電子層數相同的元素放在同一行,將最外層電子數相同的元素放在同一列。
元素周期表有7個周期,16個族。每一個橫行叫作一個周期,每一個縱行叫作一個族(VIII B族包含三個縱列)。這7個周期又可分成短周期(1、2、3)、長周期(4、5、6、7)。共有16個族,從左到右每個縱列算一族(VIII B族除外)。例如:氫屬於I A族元素,而氦屬於0族元素。
元素在周期表中的位置不僅反映了元素的原子結構,也顯示了元素性質的遞變規律和元素之間的內在聯繫。使其構成了一個完整的體系,被稱為化學發展的重要里程碑之一。
同一周期內,從左到右,元素核外電子層數相同,最外層電子數依次遞增,原子半徑遞減(零族元素除外)。失電子能力逐漸減弱,獲電子能力逐漸增強,金屬性逐漸減弱,非金屬性逐漸增強。元素的最高正氧化數從左到右遞增(沒有正價的除外),最低負氧化數從左到右遞增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外層電子數相同,核外電子層數逐漸增多,原子半徑增大,原子序數遞增,元素金屬性遞增,非金屬性遞減。
元素周期表的意義重大,科學家正是用此來尋找新型元素及化合物。
 元素符號周期表
元素符號周期表 2015年12月31日美國《科學新聞》雙周刊網站發表了題為《四種元素在元素周期表上獲得永久席位》的報導。國際純粹與套用化學聯合會(IUPAC)宣布俄羅斯和美國的研究團隊已獲得充分的證據,證明其發現了115、117和 118號元素。此外,該聯合會已認可日本理化學研究所的科研人員發現了113號元素。兩個研究團隊通過讓質量較輕的核子相互撞擊,並跟蹤其後產生的放射性超重元素的衰變情況,合成了上述四種元素。IUPAC執行理事林恩·瑟比說,有關確認新元素的報告將於2016年初公布。官方對這些元素的認可意味著它們的發現者有權為其命名並設計符號。113號元素將成為首個由亞洲人發現並命名的元素,於2016年6月正式命名為Nihonium,符號Nh。
2015年12月30日,國際純粹與套用化學聯合會宣布第113,115,117,118號元素存在,它們將由日本、俄羅斯和美國科學家命名。IUPAC官方宣布,元素周期表已經加入4個新元素。
2016年6月8日,國際純粹與套用化學聯合會宣布,將合成化學元素第113號(縮寫為Nh)、115號(Mc)、117號(Ts)和118號(Og)提名為化學新元素 。
內容
| ⅠA | ⅡA | ⅢB | ⅣB | Ⅴ B | ⅥB | ⅦB | Ⅷ | ⅠB | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||
| H 氫 | He 氦 | ||||||||||||||||
| Li 鋰 | Be 鈹 | B 硼 | C 碳 | N 氮 | O 氧 | F 氟 | Ne 氖 | ||||||||||
| Na 鈉 | Mg 鎂 | Al 鋁 | Si 矽 | P 磷 | S 硫 | Cl 氯 | Ar 氬 | ||||||||||
| K 鉀 | Ca 鈣 | Sc 鈧 | Ti 鈦 | V 釩 | Cr 鉻 | Mn 錳 | Fe 鐵 | Co 鈷 | Ni 鎳 | Cu 銅 | Zn 鋅 | Ga 鎵 | Ge 鍺 | As 砷 | Se 硒 | Br 溴 | Kr 氪 |
| Rb 銣 | Sr 鍶 | Y 釔 | Zr 鋯 | Nb 鈮 | Mo 鉬 | Tc 鎝 | Ru 釕 | Rh 銠 | Pd 鈀 | Ag 銀 | Cd 鎘 | In 銦 | Sn 錫 | Sb 銻 | Te 碲 | I 碘 | Xe 氙 |
| Cs 銫 | Ba 鋇 | 鑭系 | Hf 鉿 | Ta 鉭 | W 鎢 | Re 錸 | Os 鋨 | Ir 銥 | Pt 鉑 | Au 金 | Hg 汞 | Tl 鉈 | Pb 鉛 | Bi 鉍 | Po 釙 | At 砹 | Rn 氡 |
| Fr 鍅 | Ra 鐳 | 錒系 | Rf | Db | Sg | Bh | Hs | Mt 鿏 | Ds | Rg | Cn 鿔 | Nh | Fl | Mc 鏌 | Lv | Ts | Og |
| Uue 名稱未知 | Ubn名稱未知 | ||||||||||||||||
| 鑭系 | La 鑭 | Ce 鈰 | Pr 鐠 | Nd 釹 | Pm 鉕 | Sm 釤 | Eu 銪 | Gd 釓 | Tb 鋱 | Dy 鏑 | Ho 鈥 | Er 鉺 | Tm 銩 | Yb 鐿 | Lu 鑥 |
| 錒系 | Ac 錒 | Th 釷 | Pa 鏷 | U 鈾 | Np 鎿 | Pu 鈽 | Am 鎇 | Cm 鋦 | Bk 錇 | Cf 鐦 | Es 鑀 | Fm 鐨 | Md 鍆 | No 鍩 | Lr 鐒 |
註:2017年1月15日,全國科學技術名詞審定委員會聯合國家語言文字工作委員會組織化學、物理學、語言學界專家召開了113號、115 號、117號、118號元素中文定名會。經過參會專家熱烈討論和投票表決,形成了113號、115號、117號、118號元素中文定名方案。
新元素漢字收錄在Unicode CJK擴展區C、D和E和基本區擴充中,使用最新Windows 10或安裝字型檔補丁即可顯示部分,這部分文字包括(括弧內為其Unicode碼):
(U+2CB3B)、(U+2CB4A)、(U+2CB73)、(U+2CB5B)、(U+2CB76)、鿏(U+9FCF)、(U+2B7FC)、(U+2CB2D)、鿔(U+9FD4) 、鿭(U+9FED) 、(U+2B4E7)、(U+2B7F7) 、鿬(U+9FEC) 、鿫(U+9FEB) 。
元素列表
| 原子序數 | 符號 | 中文 | 讀音 | 相對原子質量 | 價電子 | 常見化合價 | 分類 | 英文名 | 簡介 |
| 1 | H | 氫 | qīng | 1.008 | 1s | +1、-1 | 主族 非金屬 | Hydrogen | 密度最小,同位素為氕、氘和氚 |
| 2 | He | 氦 | hài | 4.003 | 1s | 0 | 主族 非金屬 稀有氣體 | Helium | 最難液化,稀有氣體 |
| 3 | Li | 鋰 | lǐ | 6.941 | 2s | +1 | 主族 金屬 鹼金屬 | Lithium | 性質活潑 |
| 4 | Be | 鈹 | pí | 9.012 | 2s | +2 | 主族 金屬 鹼土金屬 | Beryllium | 最輕鹼土金屬元素 |
| 5 | B | 硼 | péng | 10.81 | 2s 2p | +3 | 主族 非金屬 | Boron | 單質硬度僅次於金剛石的非金屬元素 |
| 6 | C | 碳 | tàn | 12.01 | 2s 2p | 無機+2、+4、-4,有機不規則 | 主族 非金屬 | Carbon | 硬度最高(金剛石),細胞乾重中含量最高 |
| 7 | N | 氮 | dàn | 14.01 | 2s 2p | -3、 +1 、+2、 +3、 +4、+5 | 主族 非金屬 | Nitrogen | 空氣中含量最多的元素 |
| 8 | O | 氧 | yǎng | 16.00 | 2s 2p | -2、-1 | 主族 非金屬 | Oxygen | 地殼中最多,生物體內最多 |
| 9 | F | 氟 | fú | 19.00 | 2s 2p | -1 | 主族 非金屬 鹵素 | Fluorine | 最活潑的非金屬,單質不能被氧化 |
| 10 | Ne | 氖 | nǎi | 20.18 | 2s 2p | 0 | 主族 非金屬 稀有氣體 | Neon | 稀有氣體 |
| 11 | Na | 鈉 | nà | 22.99 | 3s | +1 | 主族 金屬 鹼金屬 | Sodium | 活潑,與空氣或水接觸發生反應,只能儲存在煤油或稀有氣體中 |
| 12 | Mg | 鎂 | měi | 24.31 | 3s | +2 | 主族 金屬 鹼土金屬 | Magnesium | 輕金屬之一 |
| 13 | Al | 鋁 | lǚ | 26.98 | 3s 3p | +3 | 主族 金屬 | Aluminium | 地殼裡含量最多的金屬 |
| 14 | Si | 矽 | guī | 28.09 | 3s 3p | +4、-4 | 主族 非金屬 | Silicon | 地殼中含量僅次於氧 |
| 15 | P | 磷 | lín | 30.97 | 3s 3p | -3、+3、+5 | 主族 非金屬 | Phosphorus | 白磷有劇毒且在常溫下可以自燃 |
| 16 | S | 硫 | liú | 32.06 | 3s 3p | -2、+4、+6 | 主族 非金屬 | Sulfur | 質地較軟且輕。與氧氣燃燒反應形成有毒的二氧化硫 |
| 17 | Cl | 氯 | lǜ | 35.45 | 3s 3p | -1、+1、+3、+4、+5、+7 | 主族 非金屬 鹵素 | Chlorine | 有毒、活潑 |
| 18 | Ar | 氬 | yà | 39.95 | 3s 3p | 0 | 主族 非金屬 稀有氣體 | Argon | 稀有氣體,在空氣中含量最多的稀有氣體 |
| 19 | K | 鉀 | jiǎ | 39.10 | 4s | +1 | 主族 金屬 鹼金屬 | Potassium | 比鈉活潑 |
| 20 | Ca | 鈣 | gài | 40.08 | 4s | +2 | 主族 金屬 鹼土金屬 | Calcium | 骨骼主要組成成分 |
| 21 | Sc | 鈧 | kàng | 44.96 | 3d 4s | +3 | 副族 金屬 | Scandium | 一種柔軟過渡金屬,常與釓、鉺混合存在 |
| 22 | Ti | 鈦 | tài | 47.87 | 3d 4s | +3、+4 | 副族 金屬 | Titanium | 能在氮氣中燃燒,熔點高 |
| 23 | V | 釩 | fán | 50.94 | 3d 4s | +3、+5 | 副族 金屬 | Vanadium | 高熔點稀有金屬 |
| 24 | Cr | 鉻 | gè | 52.00 | 3d 4s | +3、+4、+6 | 副族 金屬 | Chromium | 硬度最高的金屬 |
| 25 | Mn | 錳 | měng | 54.94 | 3d 4s | 區間[-3,+7]的整數 | 副族 金屬 | Manganese | 在地殼中分布廣泛 |
| 26 | Fe | 鐵 | tiě | 55.85 | 3d 4s | +2、+3、+6 | Ⅷ族 金屬 | Iron | 地殼含量第二高,單質產量最高,有磁性 |
| 27 | Co | 鈷 | gǔ | 58.93 | 3d 4s | +2、+3 | Ⅷ族 金屬 | Cobalt | 同位素60Co被套用於X光發生器中,有磁性 |
| 28 | Ni | 鎳 | niè | 58.69 | 3d 4s | +2、+3 | Ⅷ族 金屬 | Nickel | 有磁性和良好可塑性 |
| 29 | Cu | 銅 | tóng | 63.55 | 3d4s | +1、+2 | 副族 金屬 | Copper | 人類發現較早的金屬之一,可塑性很好 |
| 30 | Zn | 鋅 | xīn | 65.58 | 3d 4s | +2 | 副族 金屬 | Zinc | 人體需要的微量元素 |
| 31 | Ga | 鎵 | jiā | 69.72 | 3d4s 4p | +3 | 主族 金屬 | Gallium | 熔點低沸點高 |
| 32 | Ge | 鍺 | zhě | 72.63 | 3d4s 4p | +4 | 主族 金屬 | Germanium | 是一種重要的半導體材料 |
| 33 | As | 砷 | shēn | 74.92 | 4s 4p | -3、+3、+5 | 主族 非金屬 | Arsenic | As2O3(即砒霜)劇毒 |
| 34 | Se | 硒 | xī | 78.96 | 4s 4p | -2、+4、+6 | 主族 非金屬 | Selenium | 可使玻璃致色為鮮紅色 |
| 35 | Br | 溴 | xiù | 79.90 | 4s 4p | -1、+5、+7 | 主族 非金屬 鹵素 | Bromine | 活潑,單質為紅棕色液體 |
| 36 | Kr | 氪 | kè | 83.80 | 4s4p | +2 | 主族 非金屬 稀有氣體 | Krypton | 稀有氣體 |
| 37 | Rb | 銣 | rú | 85.47 | 5s | +1 | 主族 金屬 鹼金屬 | Rubidium | 比鉀活潑 |
| 38 | Sr | 鍶 | sī | 87.62 | 5s | +2 | 主族 金屬 鹼土金屬 | Strontium | 是鹼土元素中豐度最小的元素 |
| 39 | Y | 釔 | yǐ | 88.91 | 4d 5s | +3 | 副族 金屬 | Yttrium | 人工合成的釔鋁榴石曾被當做鑽石的替代品 |
| 40 | Zr | 鋯 | gào | 91.22 | 4d 5s | +4 | 副族 金屬 | Zirconium | 氧化物立方氧化鋯為鑽石的人工替代品 |
| 41 | Nb | 鈮 | ní | 92.91 | 4d 5s | +5 | 副族 金屬 | Niobium | 鈮鋼被用於製作汽車外殼 |
| 42 | Mo | 鉬 | mù | 95.96 | 4d 5s | +4、+6 | 副族 金屬 | Molybdenum | 植物生長所需的微量元素 |
| 43 | Tc | 鎝 | dé | 98 | 4d 5s | +4、+7 | 副族 金屬 | Technetium | 原子序數最小的放射性元素 |
| 44 | Ru | 釕 | liǎo | 101.1 | 4d 5s | +1、+4、+8 | Ⅷ族 金屬 | Ruthenium | 硬而脆呈淺灰色的多價稀有金屬元素 |
| 45 | Rh | 銠 | lǎo | 102.9 | 4d 5s | +3,+4 | Ⅷ族 金屬 | Rhodium | 現代珠寶製作過程進行表面處理的必須元素 |
| 46 | Pd | 鈀 | bǎ | 106.4 | 4d | +2、+4 | Ⅷ族 金屬 | Palladium | 被套用於酒精檢測中 |
| 47 | Ag | 銀 | yín | 107.9 | 4d 5s | +1 | 副族 金屬 | Silver | 貴金屬,曾經是全球範圍內的硬通貨,導電性最好 |
| 48 | Cd | 鎘 | gé | 112.4 | 4d 5s | +2 | 副族 金屬 | Cadmium | 重金屬,過量攝入會導致痛痛病 |
| 49 | In | 銦 | yīn | 114.8 | 5s 5p | +3 | 主族 金屬 | Indium | 可塑性強,有延展性,115In是主要核素,有放射性 |
| 50 | Sn | 錫 | xī | 118.7 | 5s 5p | +2、+4 | 主族 金屬 | Tin | 人類最早發現套用的元素之一,被用於製造容器 |
| 51 | Sb | 銻 | tī | 121.8 | 5s 5p | -3、+3、+5 | 主族 金屬 | Antimony | 熔點低,被用於製作保險絲 |
| 52 | Te | 碲 | dì | 127.6 | 5s 5p | -2、+4、+6 | 主族 非金屬 | Tellurium | 密度最大的非金屬 |
| 53 | I | 碘 | diǎn | 126.9 | 5s 5p | -1、+5、+7 | 主族 非金屬 鹵素 | Iodine | 活潑,甲狀腺所需的微量元素 |
| 54 | Xe | 氙 | xiān | 131.3 | 5s 5p | +4、+6、+8 | 主族 非金屬 稀有氣體 | Xenon | 稀有氣體 |
| 55 | Cs | 銫 | sè | 133 | 6s | +1 | 主族 金屬 鹼金屬 | Cesium | 活潑 |
| 56 | Ba | 鋇 | bèi | 137.3 | 6s | +2 | 主族 金屬 鹼土金屬 | Barium | 硫酸鋇被套用於鋇餐透視(檢查是否胃穿孔) |
| 57 | La | 鑭 | lán | 139 | 5d 6s | +3 | 副族 金屬 鑭系 | Lanthanum | 第一個鑭系元素 |
| 58 | Ce | 鈰 | shì | 140 | 4f 5d 6s | +3、+4 | 副族 金屬 鑭系 | Cerium | 用來製造打火石 |
| 59 | Pr | 鐠 | pǔ | 141 | 4f 6s | +3 | 副族 金屬 鑭系 | Praseodymium | 英文名稱最長 |
| 60 | Nd | 釹 | nǚ | 144 | 4f 6s | +3 | 副族 金屬 鑭系 | Neodymium | 磁性強 |
| 61 | Pm | 鉕 | pǒ | 145 | 4f 6s | +3 | 副族 金屬 鑭系 | Promethium | 有放射性 |
| 62 | Sm | 釤 | shān | 150.5 | 4f 6s | +3 | 副族 金屬 鑭系 | Samarium | 磁性強 |
| 63 | Eu | 銪 | yǒu | 152 | 4f 6s | +3 | 副/金/鑭 | Europium | 活潑,能放出紅光 |
| 64 | Gd | 釓 | gá | 157 | 4f 5d 6s | +3 | 副/金/鑭 | Gadolinium | 未配對電子達到上限 |
| 65 | Tb | 鋱 | tè | 159 | 4f 6s | +3 | 副/金/鑭 | Terbium | 通電時改變形狀 |
| 66 | Dy | 鏑 | dí | 162.5 | 4f 6s | +3 | 副/金/鑭 | Dysprosium | 英文名稱源自“很難得到” |
| 67 | Ho | 鈥 | huǒ | 165 | 4f 6s | +3 | 副/金/鑭 | Holmium | 銀白色,質軟,可用來制磁性材料 |
| 68 | Er | 鉺 | ěr | 167 | 4f 6s | +3 | 副/金/鑭 | Erbium | 銀灰色,質軟,可用來制特種合金,雷射器等 |
| 69 | Tm | 銩 | diū | 169 | 4f 6s | +3 | 副/金/鑭 | Thulium | 銀白色,質軟,可用來制X射線源等 |
| 70 | Yb | 鐿 | yì | 173 | 4f 6s | +2、+3 | 副/金/鑭 | Ytterbium | 銀白色,質軟,可用來制特種合金,也用作雷射材料等 |
| 71 | Lu | 鑥 | lǔ | 175 | 4f 5d 6s | +3 | 副/金/鑭 | Lutetium | 銀白色,質軟,可用於核工業 |
| 72 | Hf | 鉿 | hā | 178.5 | 5d 6s | +4 | 副/金 | Hafnium | 銀白色,熔點高。可用來制耐高溫合金,也用於核工業等 |
| 73 | Ta | 鉭 | tǎn | 181 | 5d 6s | +5 | 副/金 | Tantalum | 鋼灰色,耐腐蝕質硬,熔點高。可用於航天工業及核工業 |
| 74 | W | 鎢 | wū | 184 | 5d 6s | +4、+6 | 副/金 | Tungsten | 穩定元素中熔點最高 |
| 75 | Re | 錸 | lái | 186 | 5d 6s | +7 | 副/金 | Rhenium | 最晚被發現的穩定元素 |
| 76 | Os | 鋨 | é | 190 | 5d 6s | +4,+6,+8 | 副/金 | Osmium | 密度最大的金屬 |
| 77 | Ir | 銥 | yī | 192 | 5d 6s | +3,+4、+6、+9 | 副/金 | Iridium | 熔點高,質硬而脆。可用來制科學儀器等 |
| 78 | Pt | 鉑 | bó | 195 | 5d 6s | +2,+4 | 副/金 | Platinum | 被套用於珠寶首飾中的貴金屬,俗稱鉑金 |
| 79 | Au | 金 | jīn | 197 | 5d 6s | +1、+3 | 副/金 | Gold | 化學性質極穩定,人類最早發現及套用的貴金屬,全球硬通貨 |
| 80 | Hg | 汞 | gǒng | 200.6 | 5d 6s | +1、+2 | 副/金 | Mercury | 惟一一種在常溫下為液態的金屬 |
| 81 | Tl | 鉈 | tā | 204.5 | 6s 6p | +3 | 主/金 | Thallium | 銀白色,質軟。可用來制合金等。鉈的化合物有毒 |
| 82 | Pb | 鉛 | qiān | 207 | 6s 6p | +2、+4 | 主/金 | Lead | 密度大,熔點低,對人體有毒性。許多化妝品中必須含有的元素 |
| 83 | Bi | 鉍 | bì | 209 | 6s 6p | +3、+5 | 主/金 | Bismuth | 合金熔點很低,可用來做保險絲和汽鍋上的安全塞等 |
| 84 | Po | 釙 | pō | 209 | 6s 6p | -2、+6 | 主/金 | Polonium | 放射 |
| 85 | At | 砹 | ài | 210 | 6s 6p | +5 | 主/非/鹵 | Astatine | 放射、活潑 |
| 86 | Rn | 氡 | dōng | 222 | 6s 6p | +2 | 主/非/稀 | Radon | 放射 |
| 87 | Fr | 鍅 | fāng | 223 | 7s | +1 | 主/金/鹼 | Francium | 放射(註:放射性雖短但仍然存在) |
| 88 | Ra | 鐳 | léi | 226 | 7s | +2 | 主/金/鹼土 | Radium | 放射 |
| 89 | Ac | 錒 | ā | 227 | 6d 7s | +3 | 副/金/錒 | Actinium | 放射 |
| 90 | Th | 釷 | tǔ | 232 | 6d 7s | +4 | 副/金/錒 | Thorium | 放射 |
| 91 | Pa | 鏷 | pú | 231 | 5f 6d 7s | +5 | 副/金/錒 | Protactinium | 放射 |
| 92 | U | 鈾 | yóu | 238 | 5f 6d 7s | +3、+4,+6 | 副/金/錒 | Uranium | 放射,同位素鈾235被用於製作核子彈 |
| 93 | Np | 鎿 | ná | 237 | 5f 6d 7s | +5、+7 | 副/金/錒 | Neptunium | 放射 |
| 94 | Pu | 鈽 | bù | 244 | 5f 7s | +4、+6、+8 | 副/金/錒 | Plutonium | 放射 |
| 95 | Am | 鎇 | méi | 243 | 5f 7s | +3、+5、+7、+8 | 副/金/錒 | Americium | 人造 放射 用於煙霧報警器中 |
| 96 | Cm | 鋦 | jú | 247 | 5f 6d 7s | +3、+6、+7 | 副/金/錒 | Curium | 人造 放射 |
| 97 | Bk | 錇 | péi | 247 | 5f 7s | +3、+5 | 副/金/錒 | Berkelium | 人造 放射 |
| 98 | Cf | 鐦 | kāi | 251 | 5f 7s | +3、+5 | 副/金/錒 | Californium | 人造 放射,最貴金屬 |
| 99 | Es | 鑀 | āi | 252 | 5f 7s | +3 | 副/金/錒 | Einsteinium | 人造 放射 |
| 100 | Fm | 鐨 | fèi | 257 | 5s 7s | +3 | 副/金/錒 | Fermium | 人造 放射 |
| 101 | Md | 鍆 | mén | 258 | 5f 7s | +3 | 副/金/錒 | Mendelevium | 人造 放射 |
| 102 | No | 鍩 | nuò | 259 | 5f 7s | +2、+3 | 副/金/錒 | Nobelium | 人造 放射 |
| 103 | Lr | 鐒 | láo | 260 | 5f 7sp | +3 | 副/金/錒 | Lawrencium | 人造 放射 |
備註:104~118號元素中部分元素,其漢字簡體中文在部分設備上無法查看,故註明其繁體中文或以表意文字描述字元(IDS)描述的簡體中文如下附表:
| 原子序數 | 符號 | 簡體中文 | 繁體中文或簡體IDS | 漢語拼音 | 相對原子質量 | 價電子 | 常見化合價 | 分類 | 英文名 | 簡介 |
| 104 | Rf | 鑪/鈩 | lú | 261 | 6d 7s | +4 | 副/金 | Rutherfordium | 人造 放射 | |
| 105 | Db | /⿰釒杜 | dù | 262 | 6d 7s | +5 | 副/金 | Dubnium | 人造 放射 | |
| 106 | Sg | /⿰釒喜 | xǐ | 263 | 6d 7s | +6 | 副/金 | Seaborgium | 人造 放射 | |
| 107 | Bh | /⿰釒波 | bō | 264 | 6d 7s | +7 | 副/金 | Bohrium | 人造 放射 | |
| 108 | Hs | /⿰釒黑 | hēi | 265 | 6d 7s | +8 | 副/金 | Hassium | 人造 放射 | |
| 109 | Mt | 鿏 | 䥑 | mài | 266 | 6d 7s | 0 | 副/金 | Meitnerium | 人造 放射 |
| 110 | Ds | 鐽 | dá | 269 | 6d 7s | 0 | 副/金 | Darmstadtium | 人造 放射 | |
| 111 | Rg | 錀 | lún | 272 | 6d 7s | 0 | 副/金 | Roentgenium | 超重元素 | |
| 112 | Cn | 鿔 | 鎶 | gē | 277 | 6d 7s | 0 | 副/金 | Copernicium | 超重元素 |
| 113 | Nh | 鿭 | 鉨 | nǐ | 286 | 5f6d7s7p | +3,+1 | 主/金 | Nihonium | 不穩定的超重元素 ,人造 放射 |
| 114 | Fl | 鈇 | fū | 289 | 5f6d7s7p | ,0,+3 | 主/金 | Flerovium | 第一種表現出惰性氣體特徵的超重元素 ,人造 放射 | |
| 115 | Mc | 鏌 | ⿰釒莫 | mò | 289 | 5f6d7s7p | +1,+3 | 主/金 | Moscovium | 人工合成的放射性金屬元素 ,人造 放射 |
| 116 | Lv | 鉝 | lì | 293 | 5f6d7s7p | +4 | 主/金 | Livermorium | 人工合成的放射性化學元素 ,人造 放射 | |
| 117 | Ts | 鿬 | ⿰石田 | tián | 294 | 5f6d7s7p | -1 | 主/非/鹵 | Tennessine | 鹵族元素 ,人造 放射 |
| 118 | Og | 鿫 | ⿹氣奧 | ào | 294 | 5f6d7s7p | 主/非/稀 | Oganesson | 人工合成的稀有氣體元素 ,人造 放射 |
基本物理性質
ⅠA族(鹼金屬)
| 鹼金屬單質 | 顏色和狀態 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 氫(不屬於鹼金屬) | 無色,氣體 | 0.0000899 | -259.125 | -258.882 |
| 鋰 | 銀白色,柔軟 | 0.534 | 180.5 | 1347 |
| 鈉 | 銀白色,柔軟 | 0.97 | 97.81 | 882.9 |
| 鉀 | 銀白色,柔軟 | 0.86 | 63.65 | 774 |
| 銣 | 銀白色,柔軟 | 1.532 | 38.89 | 688 |
| 銫 | 略帶金色光澤,柔軟 | 1.879 | 28.40 | 678.4 |
1.還原性;Li
2.氧化性:Li>Na>K>Rb>Cs
3.鹼金屬元素能與水或氧氣反應生成鹼或鹼性氧化物
4.氫本來不是鹼金屬,但因為在IA族,所以歸入此表
ⅡA族(鹼土金屬)
| 鹼土金屬單質 | 顏色和狀態 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 鈹 | 鋼灰色,較硬 | 1.848 | 1278 | 2970(加壓) |
| 鎂 | 銀白色,柔軟 | 1.738 | 648.9 | 1090 |
| 鈣 | 銀白色,柔軟 | 1.550 | 839 | 1484 |
| 鍶 | 銀白色,柔軟 | 2.540 | 769(加壓) | 1384 |
| 鋇 | 銀白色,柔軟 | 3.594 | 729 | 1637 |
ⅢB族(不含鑭系和錒系)
| IIIB族元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 鈧 | 銀白色 | 2.985 | 1541 | 2830 |
| 釔 | 灰色 | 4.4689 | 1522 | 3338 |
鑭系
| 鑭系元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 鑭 | 銀白色 | 6.7 | 920 | 3469 |
| 鈰 | 灰色 | 6.9 | 799 | 3426 |
| 鐠 | 銀灰色 | 6.7 | 935 | 3212 |
| 釹 | 銀灰色 | 7.0 | 1024 | 3074 |
| 鉕** | / | / | / | / |
| 釤 | 銀白色 | 7.5 | 1072 | 1791 |
| 銪 | 銀白色 | 5.0 | 826 | 1596 |
| 釓 | 銀白色 | 7.9 | 1313 | 3266 |
| 鋱 | 銀灰色 | 8.2 | 1356 | 3230 |
| 鏑 | 銀白色 | 8.5 | 1412 | 2562 |
| 鈥 | 銀色 | 8.8 | 1474 | 2695 |
| 鉺 | 銀白色 | 9.0 | 1529 | 2863 |
| 銩 | 銀白色 | 9.3 | 1545 | 1947 |
| 鐿 | 銀白色 | 7.0 | 824 | 1193 |
| 鑥 | 銀灰色 | 9.8 | 1656 | 3315 |
ⅣB族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 鈦 | 銀白色 | 4.5 | 1660 | 3287 |
| 鋯 | 銀白色 | 6.5 | 1852 | 4377 |
| 鉿 | 銀白色 | 13.3 | 2227 | 4602 |
ⅤB族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 釩 | 銀白色 | 6.1 | 1890 | 3380 |
| 鈮 | 銀白色 | 8.6 | 2468 | 4742 |
| 鉭 | 銀白色 | 16.6 | 2996 | 5425 |
ⅥB族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 鉻 | 銀白色 | 7.2 | 1857 | 2642 |
| 鉬 | 銀色 | 10.2 | 2610 | 4615 |
| 鎢 | 銀色 | 19.3 | 3410 | 5555 |
ⅦB族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 錳 | 銀白色 | 7.44 | 1246 | 2061 |
| 鎝** | / | 11.487 | 2200 | 4877 |
| 錸 | 銀色 | 21.04 | 3180 | 5627 |
Ⅷ族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 鐵 | 銀白色 | 7.86 | 1535 | 2861 |
| 鈷 | 銀灰色 | 8.9 | 1495 | 2527 |
| 鎳 | 銀白色 | 8.9 | 1453 | 2913 |
| 釕 | 銀白色 | 12.3 | 2250 | 4150 |
| 銠 | 銀色 | 12.41 | 1966 | 3695 |
| 鈀 | 銀色 | 12.02 | 1552 | 2963 |
| 鋨 | 銀灰色 | 22.48 | 3027 | 5012 |
| 銥 | 銀白色 | 22.421 | 2443 | 4428 |
| 鉑 | 銀白色 | 21.45 | 1772 | 3825 |
ⅠB族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 銅 | 紫紅色 | 8.92 | 1084.6 | 2562 |
| 銀 | 銀白色 | 10.5 | 961 | 2162 |
| 金 | 金黃色 | 19.3 | 1046.68 | 2856 |
ⅡB族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 鋅 | 銀白色 | 7.14 | 419.6 | 907 |
| 鎘 | 銀灰色 | 8.65 | 320.9 | 765 |
| 汞 | 銀白色 | 13.59 | -38.87 | 356.6 |
ⅢA族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 硼 | 黑色 | 2.34 | 2076 | 3927 |
| 鋁 | 銀白色 | 2.7 | 660 | 2327 |
| 鎵 | 銀白色 | 5.904 | 29.76 | 2403 |
| 銦 | 銀白色 | 7.31 | 156.2 | 2080 |
| 鉈 | 銀白色 | 11.85 | 308.5 | 1457 |
ⅣA族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 碳 | 黑色(石墨、炭黑等)或無色(金剛石) | 2.267 | 3550 | 4827 |
| 矽 | 黑色 | 2.33 | 1414 | 2900 |
| 鍺 | 銀白色 | 5.35 | 938.25 | 2833 |
| 錫 | 銀白色 | 7.28 | 231.89 | 2260 |
| 鉛 | 銀白色 | 11.3437 | 327.502 | 1749 |
ⅤA族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 氮 | 無色 | 0.0012506 | -209.86 | -195.8 |
| 磷 | 黃白色(白磷) | 1.828 | 44.1 | 280.5 |
| 深紅色(紅磷) | 2.34 | 59 | 200 | |
| 砷 | 灰黑色(灰砷) | 5.73 | 817 | 614 |
| 銻 | 銀白色 | 6.697 | 630.63 | 1587 |
| 鉍 | 銀白色,因 為氧化膜常帶彩色 | 9.78 | 271 | 1564 |
ⅥA族
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 氧 | 無色 | 0.00143 | -222.65 | -182.95 |
| 硫 | 淡黃色 | 2.07 | 115.36 | 444.6 |
| 硒 | 紅色(紅硒) | 4.81 | 221 | 685 |
| 碲 | 銀白色 | 8.24 | 449.65 | 988 |
ⅦA族(鹵素)
| 元素單質 | 顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 氟 | 淺黃綠色 | 0.0017 | -219.52 | -188.12 |
| 氯 | 綠色 | 0.00321 | -100.84 | -34.04 |
| 溴 | 棕紅色 | 3.119 | -7.1 | 58.8 |
| 碘 | 紫黑色 | 4.93 | 133.5 | 154.3 |
0族(稀有氣體)
| 元素單質 | 顏色 | 通電後發光顏色 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 氦 | 無色 | 紫色 | 0.00013 | -272.98(加壓) | -268.93 |
| 氖 | 無色 | 紅色 | 0.0009 | -248.45 | -246.08 |
| 氬 | 無色 | 天藍色 | 0.00178 | -189.19 | -185.95 |
| 氪 | 無色 | 淡紅色 | 0.00374 | -157.22 | -153.22 |
| 氙 | 無色 | 白色 | 0.00589 | -111.7 | -108.12 |
由於稀有氣體有在通電時發出彩光的特性,所以可以將其製成霓虹燈。
放射性元素
| 原子序數 | 元素單質 | 密度(×10³kg/m³) | 熔點(℃) | 沸點(℃) |
| 43 | 鎝 | 11.487 | 2200 | 4877 |
| 61 | 鉕 | 7.22 | 931 | 3000 |
| 84 | 釙 | 9.4 | 254 | 962 |
| 85 | 砹 | 10 | 302 | 337 |
| 86 | 氡 | 0.00973 | -71 | -61.7 |
| 87 | 鍅 | 1.87 | 27 | 6.77 |
| 88 | 鐳 | 5 | 700 | 1737 |
| 89 | 錒 | 10.07 | 1050 | 3198 |
| 90 | 釷 | 11.71 | 1755 | 4788 |
| 91 | 鏷 | 15.37 | 1600 | 4027 |
| 92 | 鈾 | 19.05 | 1132 | 4131 |
| 93 | 鎿 | 20.05 | 640 | 4000 |
| 94 | 鈽 | 19.86 | 640 | 3228 |
| 95 | 鎇 | 13.67 | 994 | 2607 |
| 96 | 鋦 | 13.57 | 1067 | 3110 |
| 97 | 錇 | 14.79 | 986 | 3710 |
| 98 | 鐦 | 15.1 | 1652 | 3900 |
註:
放射性元素硬度多數不詳。
鐦之後的元素各項性質均不詳。
鉍放射性太弱,不歸入最後一表。
1.放射性元素硬度多數不詳。
2.鐦之後的元素各項性質均不詳。
3.鉍放射性太弱,不歸入最後一表。
順口溜
元素性質口訣
我是氫,我最輕,火箭靠我運衛星;
我是氦,我無賴,得失電子我最菜;
我是鋰,密度低,遇水遇酸把泡起;
我是鈹,耍賴皮,雖是金屬難電離;
我是硼,電子窮,我和本族大不同;
我是碳,反應慢,既能成鏈又成環;
我是氮,我阻燃,加氫可以合成氨;
我是氧,不用想,離開我就憋得慌;
![元素周期表[化學元素周期列表]](/img/c/f5e/nBnauM3XycjM4YzM5YTMxMDN0UTMyITNykTO0EDMwAjMwUzL2EzLyYzLt92YucmbvRWdo5Cd0FmLxE2LvoDc0RHa.jpg) 元素周期表[化學元素周期列表]
元素周期表[化學元素周期列表] 我是氟,最惡毒,搶個電子就滿足;
我是氖,也不賴,通電紅光放出來;
我是鈉,脾氣大,遇酸遇水就火大;
我是鎂,最愛美,攝影煙花放光輝;
我是鋁,常溫里,濃硫酸里把澡洗;
我是矽,色黑灰,信息元件把我堆;
我是磷,害人精,劇毒列表有我名;
我是硫,來歷久,沉澱金屬最拿手;
我是氯,色黃綠,金屬電子我搶去;
我是氬,活性差,霓虹紫光我來發;
我是鉀,把火加,超氧化物來當家;
我是鈣,身體愛,骨頭牙齒我都在;
我是鈧,耐溫廣,高溫合金我來幫;
我是鈦,過渡來,太空梭我來蓋;
我是釩,酸鹼煩,如虎添翼鋼加釩;
我是鉻,正六鉻,酒精過來變綠色;
我是錳,價態廣,七氧化物爆炸猛;
我是鐵,多用也,不鏽鋼喊我叫爺;
 繁體中文元素周期表
繁體中文元素周期表 我是鈷,藍色母,癌症要用六十鈷;
我是鎳,無銹鐵,鎳鈦合金能記憶;
我是銅,色紫紅,投入硝酸氣棕紅;
我是鋅,人必需,體內我立大功勳;
我是鎵,易熔化,六十七鎵是奇葩;
我是鍺,可晶格,紅外視窗能當殼;
我是砷,顏色深,三價元素奪你魂;
我是硒,補人體,口服液里有玄機;
我是溴,揮發臭,液態非金我來秀;
我是氪,很耐克,通電就顯橘紅色;
我是銣,鹼金屬,沾水煙花鉀不如;
我是鍶,天青石,八十七鍶幫醫師;
我是釔,難分離,我在特種合金里;
我是鋯,熔點高,石頭裡面很多鋯;
我是鈮,能吸氣,網路讓我當NB;
我是鉬,像石墨,提高再結晶溫度;
我是鎝,能放射,地殼裡面我沒得;
我是釕,量很少,王水我也應得了;
我是銠,光澤好,抗腐蝕性我很好;
我是鈀,把氫拉,吸氫我就破裂啦;
我是銀,不是人,只有硝酸氟化溶;
我是鎘,污染的,當年日本痛痛得;
我是銦,軟如金,輕微放射宜小心;
我是錫,五金里,與鉛熔合成焊錫;
我是銻,非Sb,雖說銻鍋那是鋁;
我是碲,毒性低,又是金屬又非金;
我是碘,升華煙,遇到澱粉藍點點;
我是氙,很陌生,人造太陽我來填;
我是銫,金黃色,入水爆炸容器破;
我是鋇,硫酸鋇,可以用來檢查胃;
我們是鑭系,個個都很稀;
鑭!鈰!鐠!工業維生素;
釹能用來造磁鐵;
鉕有放射性;
釤!銪!釓!鋱!合金很奇特;
還有鏑鈥鉺銩鐿鑥;
我是鉿,笑哈哈,我和鋯礦是一家;
我是鉭,能抗酸,我遇強酸比金懶;
我是鎢,高溫度,其他金屬早嗚呼;
我是錸,催化愛,我把氫氣吸過來;
我是鋨,和銥合,保持百年很耐磨;
我是銥,做鋼筆,只有千萬分之一;
我是鉑,很貴重,含量比金還淡薄;
我是金,很穩定,扔進王水影無形;
我是汞,吸入痛,溫度高低我能懂;
我是鉈,能脫髮,它是有毒的東西;
我是鉛,能儲電,子彈頭裡也出現;
我是鉍,半衰期,大於宇宙的年紀;
我是釙,核能破,α粒子我有很多;
我是砹,極少在,要找到我很難哎;
我是氡,放射中,三天我就造真空;
我是鍅,人造上,廿三分鐘我就亡;
我是鐳,千年累,我把癌細胞變沒;
我們是錒系,個個會放粒;
錒!釷!鏷!航飛做熱源;
鈾造核子彈很牛;
鎿也造炸彈;
鈽!鎇!鋦!錇!做核反應堆;
還有鐦鑀鐨鍆鍩鐒;
我們超錒系,我們都超重;
,,,,,鿏,,,鎶,鉨,,鏌,鉝,石田,氣奧。
(,鿏,鿔;鿭鏌,鿬鿫)
主族元素順口溜
氫鋰鈉鉀銣銫鍅——請李娜加入私訪
鈹鎂鈣鍶鋇鐳 ——媲美蓋茨被雷
硼鋁鎵銦鉈 ——碰女嫁音他
碳矽鍺錫鉛 ——探歸者西遷
氮磷砷銻鉍 ——蛋臨身體閉
氧硫硒碲釙 ——養牛西蹄撲
氟氯溴碘砹——父女繡點愛
氦氖氬氪氙氡 ——害耐亞克先動
記憶技巧
化合價記憶法
①
一價氫氯鉀鈉銀 二價氧鈣鋇鎂鋅
三鋁四矽五價磷 二三鐵、二四碳
一至五價都有氮 銅汞二價最常見
②
正一銅氫鉀鈉銀 正二銅鎂鈣鋇鋅
三鋁四矽四六硫 二四五氮三五磷
一五七氯二三鐵 二四六七錳為正
碳有正四與正二 再把負價牢記心
負一溴碘與氟氯 負二氧硫三氮磷
③
正一氫銀和鉀鈉 正二鈣鎂鋇鋅汞和銅
鋁正三 矽正四 亞鐵正二鐵正三
氯在最後負一價 氧硫最後負二價
莫忘單質價為零
④
氫正一 氧負二
一價鉀鈉銀 二價鋇鎂鋅鈣
三價鋁 鐵可變價
銅汞二價最常見
⑤
鉀鈉氫銀正一 二鈣鋇鎂鋅
鋁正三氧負二 氯常見負一
硫負二正四六 鐵有正二三
一二銅二四碳 單質永歸零
⑥
鉀鈉銀氫正一價,氟氯溴碘負一價;
鈣鎂鋇鋅正二價,通常氧是負二價
二三鐵,二四碳,三鋁四矽五價磷;
一三五七正價氯,二四六硫錳四七;
銅汞二價最常見,單質化合價為零。
鹽的溶解性記憶口訣
①鉀鈉銨鹽硝酸鹽,
完全溶解不困難。
酸類溶解除矽酸,
溶鹼鉀鈉鋇和氨。
鹽酸溶解除銀鹽,
硫酸難溶是鋇鉛。
碳酸磷酸鉀鈉銨,
碳酸氫鹽都溶完。
註:此口訣只包括中學範圍內的內容,比如酒石酸鈉、高氯酸鈉、三鈦酸鈉、偏鉍酸鈉微溶或不溶,碳酸氫鈉濃度高是沉澱(侯氏制鹼法),碳酸鈹可溶。
②
鉀鈉銨鹽均可溶;硝鹽入水影無蹤
硫酸鹽中鋇不溶;氯化鹽中銀不溶;
碳酸鹽中只溶鉀、鈉、銨。
鹼只溶鉀鈉鈣鋇銨
③
鉀鈉硝銨溶,
鹽酸除銀汞。
碳酸磷酸鹽,
能溶鉀鈉銨。
再說硫酸鹽,
不溶有鋇鉛。
最後說鹼類,
能溶鉀鈉鋇。
元素命名
IUPAC命名法
 元素周期表
元素周期表 很多人注意到,元素周期表最後幾位元素經常是以Uu開頭的,其實這只是一種臨時命名規則,叫IUPAC元素系統命名法。在這種命名法中,會為未發現元素和已發現但尚未正式命名的元素取一個臨時西方文字名稱並規定一個代用元素符號,使用拉丁文數字頭以該元素之原子序來命名。此規則簡單易懂且使用方便,而且它解決了對新發現元素搶先命名的惡性競爭問題,使為新元素的命名有了依據。如ununquadium便是由un(一)- un(一)- quad(四)- ium(元素)四個字根組合而成,表示“元素114號”。元素114命名為flerovium(Fl),以紀念蘇聯原子物理學家喬治·弗洛伊洛夫(Georgy Flyorov,1913-1990);而ununhexium便是由un(一)- un(一)- hex(六)- ium(元素)四個字根組合而成,表示“元素116號”。元素116名為livermorium (Lv),以實驗室所在地利弗莫爾市為名。
位置關係
原子半徑
![元素周期表[化學元素周期列表]](/img/b/61a/nBnauM3X2gTN0ETN4UTNxIDN0UTMyITNykTO0EDMwAjMwUzL1UzL1EzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 元素周期表[化學元素周期列表]
元素周期表[化學元素周期列表] (1)除第1周期外,其他周期元素(稀有氣體元素除外)的原子半徑隨原子序數的遞增而減小;
(2)同一族的元素從上到下,隨電子層數增多,原子半徑增大。(五、六周期間的副族除外)
元素化合價
(1)除第1周期外,同周期從左到右,第二周期元素最高正價由鹼金屬+1遞增到氮元素+5(氟無正價,氧無最高正價),其他周期元素最高正價由鹼金屬+1遞增到+7,非金屬元素負價都由碳族-4遞增到-1。
(2)同一主族的元素的最高正價、最低負價均相同。(ⅥA、ⅦA、0族除外)
單質的熔點
(1)同一周期元素隨原子序數的遞增,元素組成的金屬單質的熔點遞增,非金屬單質的熔點遞減;(副族熔點在VIB族達到最高,以後依次遞減)
(2)同一族元素從上到下,元素組成的金屬單質的熔點遞減,非金屬單質的熔點遞增。(副族不規則)
元素的金屬性
(1)同一周期的元素從左到右金屬性遞減,非金屬性遞增;
(2)同一主族元素從上到下金屬性遞增,非金屬性遞減。
最高價氧化物的水化物酸鹼性
元素的金屬性越強,其最高價氧化物的水化物的鹼性越強;元素的非金屬性越強,最高價氧化物的水化物的酸性越強。(F和O除外)
非金屬氣態
元素非金屬性越強,氣態氫化物越穩定。同周期非金屬元素的非金屬性越強,其氣態氫化物水溶液一般酸性越強;同主族非金屬元素的非金屬性越強,其氣態氫化物水溶液的酸性越弱。
單質的氧化性
一般元素的金屬性越強,其單質的還原性越強,其氧化物的氧離子氧化性越弱;元素的非金屬性越強,其單質的氧化性越強,其單原子陰離子的還原性越弱。
元素位置推斷
1、元素周期數等於核外電子層數;
2、主族元素的序數等於最外層電子數;
3、確定族數應先確定是主族還是副族,其方法是採用原子序數逐步減去各周期的元素種數,即可由最後的差數來確定。在第一至第五周期時最後的差數小於等於10時差數就是族序數,差為8、9、10時為Ⅷ族,差數大於10時,則再減去10,最後結果為族序數;在第六、七周期時差數為1:ⅠA族,差數為2:ⅡA族,差數為3~17:鑭系或錒系,差數介於18和21之間:減14,差數為22~24:Ⅷ族,差數大於25:減24,為對應的主族
根據各周期所含的元素種類推斷,用原子序數減去各周期所含的元素種數,當結果為“0”時,為零族;當為正數時,為周期表中從左向右數的縱行,如為“2”則為周期表中從左向右數的第二縱行,即第ⅡA族;當為負數時其主族序數為8+結果。所以應熟記各周期元素的種數,即2、8、8、18、18、32、32。如:①114號元素在周期表中的位置114-2-8-8-18-18-32-32=-4,8+(-4)=4,即為第七周期,第ⅣA族。②75號元素在周期表中的位置75-2-8-8-18-18=21,21-14=7,即為第六周期,第ⅦB族
稀有氣體元素
稀有氣體也稱為惰性氣體 它們的化學性質很穩定,不易和其他物質發生化學反應。穩定的稀有氣體為:氦(He) 氖(Ne)氬(Ar)氪(Kr) 氙(Xe)氡(Rn)
牢記稀有氣體元素的原子序數:2、10、18、36、54、86,通過稀有氣體的位置,為某已知原子序數的元素定位。
如:要推知33號元素的位置,因它在18和36之間,所以必在第4周期,由36號往左數,應在ⅤA族。
次級周期性
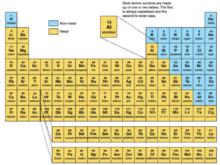 英文元素周期表
英文元素周期表 元素周期表中,從上到下p區元素的變化規律不是一條嚴格遞增的曲線,而是一條鋸齒狀曲線。曲線上有兩個拐點:第二周期和第四周期。按照相對論效應的計算,第六周期會出現第三個拐點。
第二周期的不規則性
成因是第二周期的內層電子少(只有1s ),原子半徑特別小,所以第二周期元素成鍵的方式及種類和後面幾個周期差異很大。例如氮族元素(ⅤA),第3~6周期的五氯化物均已製得,但是NF卻不存在,更不必說NCl等分子了。又如碳和矽的最大配位數不同,導致了二氧化碳和二氧化矽晶體結構的不同。
第四周期的不規則性
第四周期的p區元素剛剛經過d區,所以原子半徑比同族的第三周期相比變化不大。因此,第四周期元素很多化合物較不穩定,如HClO和HIO很早就被製得了,但HBrO卻是在1967年才製得,且氧化性為高鹵酸(高氟酸除外,因熱力學不穩定)中最強。
第六周期的不規則性(6s惰性電子對效應)
第六周期元素原子半徑太大,6s電子電子云間隔很大,不易成鍵。除Tl(Ⅲ)較穩定以外,其餘第六周期p區元素均很難顯現族價。比如BiO還原性比SbO差得多,BiO氧化性比SbO強得多,而Po(Ⅵ)和At(Ⅶ)預計不會存在。
![元素周期表[化學元素周期列表] 元素周期表[化學元素周期列表]](/img/b/0e4/nBnauM3X0ADN1UTO2ITNyIDN0UTMyITNykTO0EDMwAjMwUzLyUzL2QzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg)
