簡介
Suzuki反應對官能團的耐受性非常好 ,反應物可以帶著-CHO、-COCH3、-COOC2H5、-OCH3、-CN、-NO2、-F等官能團進行反應而不受影響。反應有選擇性,不同鹵素、以及不同位置的相同鹵素進行反應的活性可能有差別,三氟甲磺酸酯、重氮鹽、碘鎓鹽或芳基鋶鹽和芳基硼酸也可以進行反應,活性順序如下:
R2-I>R2-OTf>R2-Br>>R2-Cl
另一個底物一般是芳基硼酸,由芳基鋰或格氏試劑與烷基硼酸酯反應製備。這些化合物對空氣和水蒸氣比較穩定,容易儲存。Suzuki反應靠一個四配位的鈀催化劑催化,廣泛使用的催化劑為四(三苯基膦)鈀(0),其他的配體還有:AsPh3、n-Bu3P、(MeO)3P,以及雙齒配體Ph2P(CH2)2PPh2(dppe)、Ph2P(CH2)3PPh2(dppp)等。
Suzuki反應中的鹼也有很多選擇,最常用的是碳酸鈉。鹼金屬碳酸鹽中,活性順序為:
Cs2CO3>K2CO3>Na2CO3>Li2CO3
而且,加入氟離子(F−)會與芳基硼酸形成氟硼酸鹽負離子,可以促進硼酸鹽中間體與鈀中心的反應。因此,氟化四丁基銨、氟化銫、氟化鉀等化合物都會使反應速率加快,甚至可以代替反應中使用的鹼。
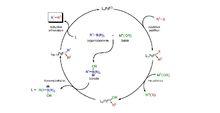
機理
首先鹵代烴2與零價鈀進行氧化加成,與鹼作用生成強親電性的有機鈀中間體4。同時芳基硼酸與鹼作用生成酸根型配合物四價硼酸鹽中間體6,具親核性,與4作用生成8。最後8經還原消除,得到目標產物9以及催化劑1。
氧化加成一步,用乙烯基鹵反應時生成構型保持的產物,但用烯丙基和苄基鹵反應則生成構型翻轉的產物。 這一步首先生成的是順式的鈀配合物,而後立即轉變為反式的異構體。還原消除得到的是構型保持的產物。
 鈴木反應
鈴木反應基本因素
SUZUKI cross coupling reaction 的基本因素總的來說可以分為下面幾個部分,
底物的活性
簡單的分類可以是:
ArN2+X->>ArI>ArBr>ArCl>ArOTf≥ArOTs, ArOMe
這裡面常用的是鹵代物,其中尤其是碘代和溴代最為常見,也是反應效果較好的。但是,ArN2+X在有些情況下,是個很好的選擇。它的製備我可以給出一個常用的方法,這裡我們的重氮鹽,是氟硼鹽.
鹼的參與
SUZUKI cross coupling reaction在沒有鹼的參與下,是很難反應的,甚至不反應!反應中鹼的影響不僅取決於鹼(負離子)的強弱,而且要兼顧陽離子的性質。
陽離子如果太小不利於生成中間的過渡態ylide(Pd)中間體,如果要弄清楚這個問題簡單的機理介紹是必不可少的,下面化學式可以明了的解釋這個原理。
通常來說,大的陽離子的鹼,如Ba,Cs,會加速反應,當陽離子太小而被禁止反應的速率和效率將顯著下降。
溶劑選擇
常用的溶劑分為質子,非質子,極性和非極性,當然他們是互相交叉的,我這裡再一次強調一下,溶劑和鹼要綜合考慮選擇,這裡只簡單的給出一些常用的二者間的配合:
Ba(OH)2/95%EtOH, Na2CO3, K2CO3, CsCO3/dioxane, DMF, CsF, K3PO4/toluene......
當然,具體到實際的套用上還要考慮你底物在這些溶劑中的溶解性。
底物
Suzuki 偶聯反應的優勢就是形成了這個過渡的中間體,讓反應更容易進行。(有點類似催化劑,嚴格說這不準確的)芳基硼酸及酯是一個對水和空氣穩定的物質,因此它的儲存將不是問題,而同時又具備好的反應活性。它是一個弱酸PKa=12左右,因此,可以在反應的後處理中利用這一點,用氫氧化鈉與它成鹽,有機溶劑提雜純化它。另外還有一點要特別注意的芳基硼酸在加熱乾燥過程中自身會脫水形成酸酐,所以如果你要測它的熔點時,你會發現這是很困難的。
芳基硼酸的合成一般的來說,有兩個方法,一個用有機鋰鹽,另外一個用格式試劑,後面一個很常用,自己也做過,前面沒用過,有誰用的可以分享一下。
現在大家更常用的是芳基硼酯,這裡面以頻那醇硼酸酯最普遍,這個方法是由Miyanra小組對Suzuki偶聯反應改良產生的感興趣的可以看看這個文獻:
J. Org. Chem., 1995, 60 (23), pp 7508–7510, DOI:10.1021/jo00128a024
芳基頻那醇硼酸酯製備方法中,用Pd(dppf)Cl2作為催化劑適用碘代物,和溴代物以及三氟甲磺醯基物。用Pd(dba)3/PCy3,和Pd(OAc)2做為不活潑的氯化物的製備。
特別說一點,這裡的用的鹼不能用太強的,一般用醋酸鉀就可以了,太強的鹼會造成同分子的雙分子偶合,這是我們不願意看到的。
催化劑
這是這個反應最精髓的地方,也是最新最有挑戰性的一個領域。
這裡我只簡單的介紹一下,Suzuki偶聯反應的催化劑主要有兩大類Pd類,Ni類,前者可用於含水體系,耐受很多的官能團,後者在反應中必需是無水無氧的。
Suzuki偶聯反應的催化劑的發展經歷過三個過程:
(1) 簡單的零價Pd(0)和Ni(0)的鹽和磷的配合物,反應活性較低如PdCl2,Pd/C等
(2) 高活性的鈀催化劑
(3) 高活性,可反覆利用的催化劑
我們日常用的多的是第一和第二類,第一類中以Pd(PPh3)4為最常見,最廣譜,用於底物是溴化物和碘化物最好,如果用於不活潑的氯化物反應的條件要苛刻一點。一般的配體就是PPh3,PCy3。
Suzuki偶聯反應的催化劑都是怕氧的所以反應進行中脫氧是必備的一步,這裡很有意思的是第三代的催化劑,它具有高活性,高效率,它是固態的不溶於溶劑中的因此反應後處理通過過濾出去,回收反覆利用,這樣的體系,要加點季銨鹽提高催化劑的穩定性(同時是不是還有相轉移催化劑的功能?)。
諾貝爾化學獎
美國科學家理察-海克和日本科學家根岸英一、鈴木彰因在研發“有機合成中的鈀催化的交叉偶聯”而獲得2010年度諾貝爾化學獎。這一成果廣泛套用於製藥、電子工業和先進材料等領域,可以使人類造出複雜的有機分子。
瑞典皇家科學院諾貝爾頒獎委員會在頒獎狀中稱,鈀催化的交叉偶聯是今天的化學家所擁有的最為先進的工具。這種化學工具極大地提高了化學家們創造先進化學物質的可能性,例如,創造和自然本身一樣複雜程度的碳基分子。碳基(有機)化學是生命的基礎,它是無數令人驚嘆的自然現象的原因:花朵的顏色、蛇的毒性、諸如青黴素這樣的能殺死細菌的物質。有機化學使人們能夠模仿大自然的化學,利用碳能力來為能發揮作用的分子提供一個穩定的框架,這使人類獲得了新的藥物和諸如塑膠這樣的革命性材料。

