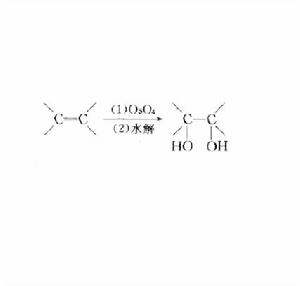
反應機理
反應常用丙酮/水、或者t-BuOH/水的混合溶劑體系。
由於四氧化鋨價貴且有毒,實驗中常用催化量的四氧化鋨和其他的氧化劑,如與氯酸鹽、碘酸鹽、過氧化氫等共用,或者用揮發度較低的鋨酸鉀代替。作為共氧化劑、處理操作方便的固體試劑N-甲基-N-氧化嗎啉(NMO)是最常用的(Upjohn法)。其他的氧化劑如氧化三甲胺(MeNO)、t-BuOOH(Milas法)、OsCl-KFe(CN)等也被使用。用高碘酸鈉(NaIO)做共氧化劑時,生成的二醇會被繼續氧化斷裂,生成相應的羰基化合物(Lemieux-Johnson酸化)。
反應歷程,形成環狀的鋨酸酯。由於鋨酸酯不穩定,常加入叔胺(如吡啶)組成配合物,以穩定鋨酸酯,加速反應。加入甲磺醯胺(MsNH)也能起到加速反應的效果(MsNH能促進中間體鋨酸酯的水解)。
四氧化鋨與烯烴發生[3+2]加成、生成鋨酸酯中間體。使催化劑再生,必須通過加水分解餓酸酯。為此,反應通常在含水體系中進行。該加水分解是該催化體系的限速步驟。
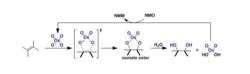 反應機理
反應機理反應實例
一、高碘酸鈉做共氧化劑時、一鍋法是烯烴氧化斷裂。2,6-二甲基吡啶添加在體系中可防止副反應。
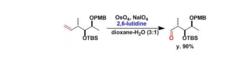 Osmium tetroxide氧化
Osmium tetroxide氧化二、氯胺-T等共存下、可以發生醇胺化。
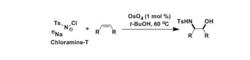 Osmium tetroxide氧化
Osmium tetroxide氧化