簡介
盧卡斯試劑又稱鹽酸—氯化鋅試劑,適用於3一6個碳原子的伯 、仲、叔醇的特徵鑑別。在溫水浴中試劑與叔醇,立 即反應、發熱並產生鹵代烴油狀物,該油狀物不溶於反應試劑而呈渾濁並分層。在溫水浴中試劑與仲醇反應稍慢,需幾分鐘時間,呈渾濁而分層,發熱不明顯;而試劑與伯醇在常溫下幾小時也難分層 。利用上 述反應速度的不同,盧卡斯試劑作為實驗室區別伯、仲、叔醇的一種試劑 。
在有機分析中用作伯、仲、叔醇的鑑別試劑。叔醇或苄醇與該試劑混合後,溶液立即渾濁或分層:5~10min內分層的為仲醇,不分層的為伯醇。
製備
傳統方法
將無水氯化鋅在蒸發皿中加熱熔融,稍冷後在乾燥器中冷至室溫,取出搗碎,稱取136g溶於90ml濃鹽酸中 (溶解時有大量氣體和熱量放出)冷卻後貯於試劑瓶中,塞緊瓶塞,備用 。
此法配製的盧卡斯試劑穩定性較差,放置時間短,使用時要求臨時配製,實驗效果不穩定,現象不明顯、且配置方法複雜。
改進
稱取5g鋅粒,先用HCl 5ml按1:1 洗滌去掉氧化物,然後用乾淨濾紙條吸乾。將鋅粒放人200ml 燒杯中 ,把燒杯放在通風櫥內用量筒量取40ml 濃HCl於燒杯 中,此時鋅粒溶解並有大量氣體和熱量放出,溶解完全後,稍冷卻轉人200ml 試劑 瓶中,再加人60ml 濃 HCI ,塞緊瓶塞即得到鹽酸氯化鋅試劑 。
實驗方法
在3支大試管中分別加上述改進方法配製的試劑各1ml,然後在各試管中分別加人正丁醇、仲丁醇、叔丁醇各 5 滴,振盪。放在溫水浴中加熱,觀察試管內溶液變渾濁的時間 。叔丁醇加人盧卡斯試劑後振盪,2min內即變渾濁, 靜置後分層。仲醇加人盧卡斯試劑後,在溫水浴中加熱數分鐘後,振盪試管靜置,溶液慢慢出現渾濁, 然後分層,而正丁醇在加熱的情況1h也不分層。
將上述配製的盧卡斯試劑放置一段時間後,再進行穩定性實驗。通過試驗,試劑放置20d左右仍然較穩定,能與叔丁醇在2min之內出現渾濁並分層;在溫水浴能與仲丁醇在10min之內出現渾濁並分層,而滴入正丁醇不出現渾濁和分層。
試驗失敗原因
1、盧卡斯試劑不夠靈敏:醇與盧卡斯試劑反應是單分子親核取代反應機理,可表示如下:
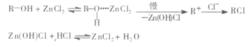 盧卡斯試劑
盧卡斯試劑由此可以看出,HCl和ZnCl都參與了反應過程,試劑中ZnCl和HCl的濃度是決定反應速率的重要因素。
ZnCl和 濃 鹽 酸不但要有恰當的配比,還應該具有足夠高的濃度,試劑才會具有足夠高的 靈敏度。
2、生成的低級氯代烴易揮發
盧卡斯試驗生成的低級氯代烴的沸點比較低,相對密度都低於盧卡斯試劑。以正丁基氯、仲丁基氯和叔丁基氯為例,它們的沸點和相對密度如下表:
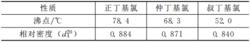 幾種氯代烴的沸點和密度
幾種氯代烴的沸點和密度可見盧卡斯試驗中生成的低級氯代烴是容易揮發散失的。由於仲醇反應較慢,伯醇反應更慢,氯代烷烴一邊生成一邊揮發,所以不容易形成顯著的渾濁或分層現象;實驗中發現,即使是反應最快的叔醇,原先出現的渾濁或分層現象時間稍長也會消失。因此生成的氯代烴揮發散失也是導致盧卡斯試驗失敗的原因之一。
盧卡斯測試
盧卡斯測試基於伯醇、仲醇和叔醇和氯化氫反應速率的不同:
ROH + HCl → RCl + HO
等物質的量的ZnCl和鹽酸組成了盧卡斯試劑,在鹽酸的作用下,醇中的羥基發生質子化,脫去一分子水形成碳正離子,碳正離子和氯離子結合生成氯代烷。反應的快慢和醇對應的碳正離子穩定性有關,由於烴基的推電子性,叔碳正離子最穩定,容易生成,而伯碳正離子最不穩定,難以生成,所以可以通過反應的快慢判斷低級醇的結構。
各類醇與盧卡斯試劑的反應速率:苯甲型醇,烯丙型醇,叔醇>仲醇>伯醇:
•無可見反應,溶液不變渾濁,原物質為伯醇。
•溶液在5到10分鐘之內變為雲霧狀,原物質為仲醇。
•溶液立即變成雲霧狀,發生相分離,原物質為叔醇。
此外,由於p-π共軛,苯甲型醇、烯丙型醇也很容易形成碳正離子而與盧卡斯試劑迅速反應。低級一元醇且是六個碳以下的醇,在反應中盧卡斯試劑與醇發生取代反應。

