簡介
簡稱馬氏規則,是有機反應中的一條重要規律,這個規則是由俄羅斯化學家馬爾科夫尼科夫在1870年提出的。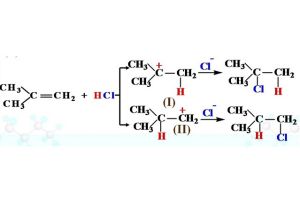 馬氏規則
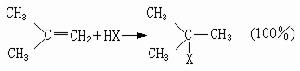
馬氏規則馬氏規則確定:在烯烴的親電加成反應中,加成試劑的正性基團將加到烯烴雙鍵(或叄鍵)帶取代基較少(或含氫較多)的碳原子上。它闡明了在加成試劑與烯烴發生加成反應中,如可能產生兩個異構體時,為何往往只產生其中的一種。例如,在鹵化氫對異丁烯的加成反應中,HX的正離子H+連線到雙鍵末端的碳原子上,形成叔鹵化物:
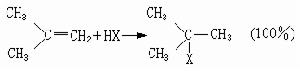

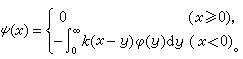
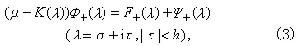
故前者成為加成反應的主要方向。
馬氏規則原理
 化學式
化學式馬氏規則的原因是親電加成反應中生成了較為穩定的碳正離子。加上一個H+的碳原子會使其他碳原子上引入一個正電荷,形成一個碳正離子。由於誘導效應和超共軛效應,取代基(碳上連線的碳或給電子基團)。
越多的碳正離子越穩定。而加成反應的主要產物會由一個更加穩定的中間體產生。所以烯烴加溴化氫時,溴化氫中的氫總是加在連氫最多的碳上,而鹵素基團加在連氫最少的碳上。然而,其它比較不穩定的碳正離子仍然存在,通過它們生成的產物是不符合馬氏規則的,通常是反應的副產物。
這個規則可以概括為“氫多加氫”或“富者愈富,而窮者愈窮”:連氫多的碳會得到另外的氫,而連氫少的碳會得到另外的取代基。對於其他不對稱親電試劑也是如此。正電基團加到取代少的碳上,負電基團加到取代多的碳上。
歷史資料
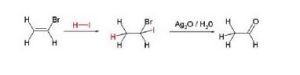
馬爾科夫尼科夫用於證明其規則的一個反應是碘化氫和溴乙烯的加成。根據他的規則,鹵素將會加在已經有一個鹵素的碳上。而這個產物(1-碘-1-溴乙烷)是偕鹵化物水解反應的產物。用潮濕的氧化銀處理這個產物則會得到乙醛,證明了產物的結構。有人認為,在1869年馬爾科夫尼科夫的論文是粗心的,因為他自己沒有做很多實驗。這個規則僅僅作為了一個四頁長的腳註出現在了一篇26頁的文章中。因此他的規則經過了大約60年才被廣泛認可。
反馬氏規則
 反應式
反應式不對稱烯烴與鹵化氫等親電試劑發生加成反應的取向與按馬氏規則預測的取向不一致時,稱為反馬爾可夫尼可夫規則。反馬氏規則的情況大致有兩種:(1)在光及過氧化物作用下,發生了游離基加成反應(參見過氧化物效應);(2)當親電試劑中氫原子的電負性大於所連的原子或原子團時,從形式上看加成的取向是違反馬氏定則的。具體的例子如:三氟乙烯和氯化氫加成違反馬氏定則,烯烴的硼氫化是反馬氏的,等等。
很多反應的區域選擇性性質都與馬氏規則所做的預測相悖,這些反應稱為反馬氏規則的反應。氫加到含氫較少的碳原子上,鹵素等負電基團加成到了含氫較多的碳原子上。
反馬氏規則的一個例子是吸電子基團取代的烯烴與親電試劑的反應。受誘導效應影響,當烯烴雙鍵碳上連有-CF3等吸電子基時,直接與這些基團相連的碳原子帶有部分負電荷,它所形成的碳正離子是不穩定的。雖然親電加成仍然符合電性規律,但是H+會加到遠離吸電子基的雙鍵碳上,生成反馬氏規則的產物。
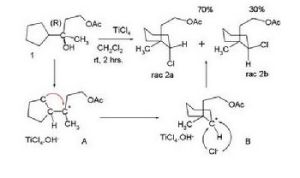
反馬氏規則的性質也可以發生在炔烴的親電加成反應上。比如苯乙炔和水的反應,在金的催化下,會得到苯乙酮,而在釕配合物的催化下,則會得到異構體苯乙醛。由於碳正離子會發生重排,故重排後生成的產物也往往不符合馬氏規則。下圖中單一構型的1在四氯化鈦催化下重排,會生成外消鏇體2a和2b。
這些產物可以被解釋為:1中羥基離去生成了一個三級碳正離子A,而這個三級碳正離子會重排成二級碳正離子B。氯可以從兩邊進攻這個碳正離子,從而得到兩種差向異構體。
對馬爾科夫尼科夫規則的補充
烯烴能與鹵化氫(氯化氫,溴化氫或碘化氫)加成生成鹵代烷.如:乙烯+溴化氫→溴代乙烷
不對稱烯烴與鹵化氫加成時顯然可以生成兩種產物.如:丙烯+溴化氫→溴丙烷/2-溴丙烷