前言
本標準代替GB/T 5009.211-2008《食品中葉酸的測定》 。
本標準與GB/T 5009.211-2008相比,主要變化如下:
—標準名稱修改為“食品安全國家標準食品中葉酸的測定”;
—修改了菌種名稱,由乾酪乳桿菌改為鼠李糖乳桿菌;
—刪除了培養基和用於葉酸鹽降解的雞胰腺供貨信息;
—刪除了附錄B中酶解酪蛋白液的製備方法;
—增加了檢出限和定量限。
範圍
本標準規定了食品中葉酸的測定方法。
本標準適用於食品中葉酸的測定。
原理
葉酸是鼠李糖乳桿菌Lactobacillus casei spp. rhamnosus(ATCC 7169)生長所必需的營養素,在定控制條件下,將鼠李糖乳桿菌液接種至含有試樣液的培養液中,培養一段時間後測定透光率(或吸度值),根據葉酸含量與透光率(或吸光度值)的標準曲線計算出試樣中葉酸的含量。
試劑和材料
註:除非另有說明,本方法所用試劑均為分析純,水為GB/T 6682規定的二級水。
試劑
鹽酸(HCl)
氫氧化鈉(NaOH)
氯化鈉(NaCI)
十二水合磷酸鈉(Na3HPO4·12H2O)
七水合磷酸氫二鈉(Na2HPO4·7H2 O)
磷酸氫二鉀(K2 HPO4 )
三水合磷酸二氫鉀(KH2PO4·3H2O)
七水合硫酸鎂(MgSO4·7H2 O)
七水合硫酸亞鐵(FeSO4·7H2O)
一水合硫酸錳(MnSO4·H2O)
三水合乙酸鈉(CH3CooNa·3H2O)
葡萄糖(C6H12 O6)
抗壞血酸(C6H8O6)
甲苯(C7H8)
無水乙醇(C2H6O)
雞胰腺乾粉:含γ~谷胺酸基水解酶
木瓜蛋白酶:酶活力≥5 U/mg
a一澱粉酶:酶活力≥1.5 U/mg
蛋白陳:含氮量≥10%
酵母提取物(乾粉):含氮量≥10%
瓊脂。
試劑配製
磷酸緩衝液(0.05 mol/L, pH6.8):分別稱取4.35 g十二水合磷酸鈉和10.39 g七水合磷酸氫二鈉,用水溶解並稀釋至1L,混勻。加入2 mL甲苯,室溫保存。臨用前按大約5 mg/mL的比例加入抗壞血酸作為葉酸保護劑,加入量以pH達到6.8為宜。
乙醇溶液(20%,體積分數):量取200 mL無水乙醇與800 mL水混勻。
氫氧化鈉乙醇溶液(0.01 mol/L):稱取0.1 g氫氧化鈉,用乙醇溶液溶解並稀釋至1L,混勻。
氫氧化鈉溶液((1 mol/L):稱取:10 g氫氧化鈉,加水溶解並稀釋至1L,混勻。
鹽酸溶液((1 mol/L):量取83.3 mL鹽酸,用水稀釋至1L_,混勻。
鹽酸浸泡液:量取100 mL鹽酸與50倍水混合。
雞胰腺溶液:稱取100 mg雞胰腺乾粉,加入20 mL磷酸緩衝液,搖勻。現用現配。
蛋白酶一澱粉酶液:分別稱取200 mg木瓜蛋白酶和α-澱粉酶,加入20 mL磷酸緩衝液研磨至勻漿,3 000 r/min離心5 min。現用現配。
培養基
甲鹽溶液:分別稱取25 g磷酸氫二鉀和25 g三水合磷酸二氫鉀,加水溶解並稀釋至500 mL,混勻。加入1 mL甲苯,2 ℃~4℃冰櫃可保存1年。
乙鹽溶液:分別稱取10 g七水合硫酸鎂、0.5 g氯化鈉,0.5 g七水合硫酸亞鐵和0. 5 g一水合硫酸錳,加水溶解並稀釋至500 mL。加5滴鹽酸,於2℃~4℃冰櫃可保存1年。
瓊脂培養基:按表1稱量或吸取各試劑,加水至100 mL,混合,沸水浴加熱至瓊脂完全溶化。趁熱用1 mol/L鹽酸溶液和1 mol/L氫氧化鈉溶液調節pH至6.8士0.1。儘快分裝,根據試管內徑粗細加入3 mL~5 mL,液面高度不得低於2 cm。塞上棉塞,121 ℃ (0.10 MPa~0.12 MPa)高壓滅菌15 min。試管取出後直立放置,待冷卻後於冰櫃內保存,備用。
葉酸測定用培養液:可按附錄A配製葉酸測定用培養液,也可直接由試劑公司購買效力相當的葉酸測定用培養基,用前按說明書配製。
標準品
葉酸標準品(C19 H19 N7 O6 ):純度≥99%。
標準溶液的配製
葉酸標準儲備液(20.0μg/mL):精確稱取20.0 mg葉酸標準品,用氫氧化鈉乙醇溶液溶解並轉
移至1 000 m工矛容量瓶中,定容至刻度。
葉酸標準儲備液濃度標定:準確吸取1.0 m工矛標準儲備液至5 mL矛容量瓶中,用氫氧化鈉溶液定容至刻度。用紫外一可見分光光度計,於比色杯厚度1 cm,波長256 nm條件下,以氫氧化鈉乙醇溶液調零點,測定3次標準溶液吸光度值,取平均值按式(1)計算葉酸標準儲備液濃度。
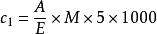 食品中葉酸的測定
食品中葉酸的測定.............(1)
式中:
c1—標準儲備液中葉酸濃度,單位為微克每毫升(mg/mL) ;
A—平均吸光度值;
E—摩爾消光係數,數值為21 500;
M—葉酸相對分子質量,數值為441.12;
5—稀釋倍數;
1 000—由克每升換算為微克每毫升的換算係數。
標定好的葉酸標準儲備液儲存於棕色瓶中,於2 ℃~4℃冰櫃可保存兩年。
葉酸標準中間液(0.200μg/mL):準確吸取1.00 mL矛葉酸標準儲備液置於100 mL棕色容量瓶中,用氫氧化鈉乙醇溶液稀釋並定容至刻度,混勻後儲存於瓶中2℃~4℃冰櫃可保存1年。
葉酸標準工作液(0.200 ng/mL):準確吸取1.00 mL葉酸標準中間液置於1 000 mL容量瓶中,用水稀釋定容至刻度,混勻。現用現配。
儀器和設備
天平:感量為0.1 mg和1 mg
恆溫培養箱:37℃士1℃
壓力蒸汽消毒器:121 ℃ (0.10 MPa~0.12 MPa)
渦旋振盪器
離心機:轉速)3 000 r/min
接種環
pH計:精度為士0.1
紫外-可見分光光度計
超淨工作檯
超音波振盪器
菌種的製備與保存
菌種
鼠李糖乳桿菌Lactobacillus casei spp. rhamnosus(ATCC 7169)
儲備菌種的製備
將菌種鼠李糖乳桿菌轉接至瓊脂培養基中,在37℃士1℃恆溫培養箱中培養20 h~21 h,連續傳種2代一3代。取出後放入2 ℃~4℃冰櫃作為儲備菌株保存。每月至少傳代1次,可傳30代。
實驗前將儲備菌株接種至瓊脂培養基中,在37℃士1℃恆溫培養箱中培養20 h~ 21 h以活化菌株,用於接種液的製備。
註:保存數周以上的儲備菌種,不能立即用作接種液製備,實驗前宜連續傳種2代一3代以保證細菌活力。
接種液的製備
試驗前一天,取2mL葉酸標準工作液與4mL葉酸測定用培養液混勻,分裝至2支5mL離心管中,塞上棉塞,於121 ℃ (0.10 MPa~0.12 MPa)高壓滅菌15 min後即為種子培養液。冷卻後用接種環將活化的菌株轉種至2支種子培養液中,於37℃士1℃恆溫培養箱中培養20 h~21 h。取出後將種子培養液混懸,無菌操作下用無菌注射器吸取0. 5 mL轉種至另兩支已消毒但不含葉酸的培養液中,於37℃士1℃再培養6h。振盪混勻,製成接種液,立即使用。
分析步驟(所有操作均需避光進行)
試樣製備
谷薯類、豆類、乳粉等試樣需粉碎、研磨、過篩(篩板孔徑0.3 mm~0.5 mm);肉、蛋、堅果等用勻質器製成食糜;果蔬、半固體食品等試樣需勻漿混勻;液體試樣用前振搖混合。於1℃冰櫃可保存1周。
試樣提取
直接提取法
形態為顆粒、粉末、片劑、液體的營養素補充劑或強化劑、預混料;以飲料為基質或葉酸添加量>100 μg/100 g的食品可採用直接提取法。
準確稱取固體試樣0.1 g~0.5 g或液體試樣0. 5 g~2 g,精確至0.001 g,轉入100 mL錐形瓶中,加入80 mL氫氧化鈉乙醇溶液,具塞,超聲振盪2 h~1 h至試樣完全溶解或分散,用水定容至刻度。
酶解提取法
谷薯類、肉蛋乳類、果蔬菌藻類、豆及堅果類等食品試樣宜採用酶解提取法。
準確稱取適量試樣(約含0.2μg~2μg葉酸),精確至0.001 g。一般谷薯類、肉類、乳類、新鮮果蔬、菌藻類試樣2g~5g;蛋類、豆、堅果類、內臟、乾制試樣0.2 g~2 g;流質或半流質試樣5 g~10 g。轉入100 mL錐形瓶中,加30 mL磷酸緩衝液,振搖5 min後,具塞,於121 ℃ (0.10 MPa~0.12 MPa)高壓水解15 min。
試樣取出後冷卻至室溫,加入1 mL雞胰腺溶液;含有蛋白質、澱粉的試樣需另加入1 mL蛋白酶-澱粉酶液,混合。加入3滴一5滴甲苯後,置於37℃士1℃恆溫培養箱內酶解16 h~20 h。取出,轉入100 mL容量瓶,加水定容至刻度,過濾。 另取一隻錐形瓶,同試樣操作,定容至100 mL,過濾。作為酶空白液。
註:以穀物、乳粉等為基質的配方食品如需計量基質本底葉酸含量,可採用酶解法提取。
稀釋
根據試樣中葉酸含量用水對試樣提取液進行適當稀釋,使試樣稀釋液中葉酸含量在0.2 ng/mL~0.6ng/mL範圍內。
測定系列管制備
所用試管使用前洗刷乾淨,沸水浴30 min,瀝乾後放入鹽酸浸泡液中浸泡2h,經170℃±2 0C烘乾3h後使用。
試樣和酶空白系列管
取3支試管,分別加入0.5 mL、1.0 mL、 2.0 mL試樣稀釋液(V),補水至5.0 mL。加入5.0 mL葉酸測定用培養液,混勻。另取3支試管同法加入酶空白液。
標準系列管
取試管分別加入葉酸標準工作溶液0.00 mL、0.25 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL、
2.50 mL、3.00 mL、4.00 mL和5.00 mL,補水至5.00 mL,相當於標準系列管中葉酸含量為0.00 ng、0.05 ng、 0.10 ng、0.20 ng、0.30 ng、0.10 ng、0.50 ng、0.60 ng、0.80 ng、1.00 ng,再加入5.0 m L葉酸測定用培養液,混勻。為保證標準曲線的線性關係,應製備2套一3套標準系列管,繪製標準曲線時,以每個標準點平均值計算。
滅菌
將所有測定系列管塞好棉塞,於121 ℃ (0.10 MPa~0.12 MPa)高壓滅菌15 min。
接種和培養
待測定系列管冷卻至室溫後,在無菌操作條件下,用預先高壓滅菌的移液管向每支測定管加接種液20μL,混勻。塞好棉塞,置於37℃士1℃恆溫培養箱中培養20 h~10 h,直至獲得最大混濁度,即再培養2h透光率(或吸光度值)無明顯變化。另準備一支標準0管(含0.00 ng葉酸)不接種作為0對照管。
測定
將培養好的標準系列管、試樣和酶空白系列管用漩渦混勻器混勻。用厚度為1 cm比色杯,於510 nm處,以未接種0對照管調節透光率為100%(或吸光度值為0),依次測定標準系列管、試樣和酶空白系列管的透光率(或吸光度值)。如果0對照管有明顯的細菌增長;或與0對照管相比,標準0管透光率在90%以下(或吸光度值在0.1以上),或標準系列管透光率最大變化量<40%(或吸光度值最大變化量<0.4),說明可能有雜菌或不明來源葉酸混入,需重做實驗。
注:葉酸測定適宜的光譜範圍540 nm~610 nm。
分析結果表述
標準曲線:以標準系列管葉酸含量為橫坐標,每個標準點透光率(或吸光度值)均值為縱坐標,繪製標準曲線。
試樣結果計算:從標準曲線查得試樣或酶空白系列管中葉酸的相應含量(Cx),如果3支試樣系列管中有2支葉酸含量在0.10 ng~0.80 ng範圍內,且各管之間折合為每毫升試樣提取液中葉酸含量的偏差小於10%,則可繼續按式(2)、式(3)、式(4)進行結果計算,否則需重新取樣測定。
試樣稀釋液葉酸濃度按式(2)計算:
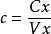 食品中葉酸的測定
食品中葉酸的測定............(2)
式中:
c—試樣稀釋液中葉酸濃度,單位為納克每毫升(ng/mL) ;
Cx—從標準曲線上查得試樣系列管中葉酸含量,單位為納克(ng);
Vx—製備試樣系列管時吸取的試樣稀釋液體積,單位為毫升(mL) 。
採用直接提取法的試樣葉酸含量按式(3)計算:
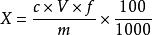 食品中葉酸的測定
食品中葉酸的測定..........(3)
式中:
X——試樣中葉酸含量,單位為微克每百克(μg/100g);
c—試樣稀釋液葉酸濃度平均值,單位為納克每毫升(ng/ml) ;
V—試樣提取液定容體積,單位為毫升(ml) ;
f—試樣提取液稀釋倍數;
m—試樣質量,單位為克(g};
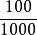 食品中葉酸的測定
食品中葉酸的測定—由納克每克(ng/g)換算為微克每百克(μg/100g)的係數。
採用酶解提取法的試樣葉酸含量按式(4)計算:
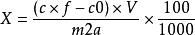 食品中葉酸的測定
食品中葉酸的測定.........(4)
式中:
X—試樣中葉酸含量,單位為微克每百克(μg/100g);
c—試樣稀釋液中葉酸濃度平均值,單位為納克每毫升(ng/mL) ;
f—試樣提取液稀釋倍數;
c0—酶空白液中葉酸濃度平均值,單位為納克每毫升(ng/mL) ;
V—試樣提取液定容體積,單位為毫升(mL) ;
m—試樣質量,單位為克(g};
 食品中葉酸的測定
食品中葉酸的測定_由納克每克(ng/g)換算為微克每百克(μg/100g)的係數。
注1:液體試樣葉酸含量也可以微克每百毫升(μg/100 ml)為單位。
注2:葉酸測定也可採用預包埋菌種的葉酸測定用試劑盒(微生物法),測定過程應參照試劑盒說明書,效果相當。
以重複性條件下獲得的兩次獨立測定結果的算術平均值表示,結果保留三位有效數字。
精密度
一般食品在重複性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的15%;營養素補充劑和強化食品在重複性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的5%。
其他
果蔬類試樣稱樣量為5g時,檢出限為0.2μg/100g,定量限為0.4μg/100g;蛋白質、澱粉含量高的試樣稱樣量為5g時,檢出限為1.0μg/100g,定量限為2.0μg/100g;營養強化劑和強化食品稱樣量為1g時,檢出限為0.5 μg/100g,定量限為1.0μg/100g。

