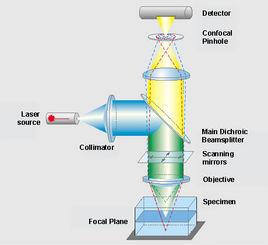
優點:
螢光標記的特異性及可定量性。
共聚焦針孔的運用,有效的消除了焦平面上下散射光,提高軸向解析度。
點光源雷射的套用,對螢光素能達到有效的激發,激發的特異性高,降低對螢光的淬滅,增強側向解析度。
雙光子的套用,相對較低平均功率的紅外激發,大大減低對活細胞的損傷;螢光激發高度聚焦在焦點處,可避免了焦點以外的光漂白(Photobleaching)和光毒(cytotoxicity)作用,延長觀察時間,是目前用於活細胞跟蹤的最理想方法。
脈衝雷射散射和吸收程度小,透射性強,對厚樣品的穿透可達400um,是對厚的組織分析的最首先方法。
結合META新技術,尤其對螢光蛋白成像具有更方便,更精確的效果。
1.螢光標記的特異性及可定量性。
2.共聚焦針孔的運用,有效的消除了焦平面上下散射光,提高軸向解析度。
3.點光源雷射的套用,對螢光素能達到有效的激發,激發的特異性高,降低對螢光的淬滅,增強側向解析度。
4.雙光子的套用,相對較低平均功率的紅外激發,大大減低對活細胞的損傷;螢光激發高度聚焦在焦點處,可避免了焦點以外的光漂白(Photobleaching)和光毒(cytotoxicity)作用,延長觀察時間,是目前用於活細胞跟蹤的最理想方法。
5.脈衝雷射散射和吸收程度小,透射性強,對厚樣品的穿透可達400um,是對厚的組織分析的最首先方法。
6.結合META新技術,尤其對螢光蛋白成像具有更方便,更精確的效果。
套用領域:
共聚焦及雙光子在現代生物學研究中有如下套用:
多色螢光成像(Multi-color imaging),具有多磁軌和雙向掃描,曲線掃描等特性。
三維重構(Three dimentional reconstruction)及定量分析。
實時成像(Time series,real time imaging),可進行活細胞跟蹤。
離子成像(Ion imaging)/比率成像(Ratio imaging),可進行Ca2+,Mg2+,H+,Na+,K+,Zn2+,Ni2+,Fe2+,Hg2+,Pb2+及Cd2+等成像。
螢光原位雜交(FISH:fluorescence in situ hybridization);
螢光漂白恢復(FRAP:fluorescence recovery after photobleaching);
螢光共振能量轉移(FRETM:fluorescence resonance energy transfer;
光生命期成像顯微術(FLIM:fluorescence lifetime imaging microscopy)。
螢光相關光譜(FCS:fluorescence correlation spectroscopy)。
1.多色螢光成像(Multi-color imaging),具有多磁軌和雙向掃描,曲線掃描等特性。
2.三維重構(Three dimentional reconstruction)及定量分析。
3.實時成像(Time series,real time imaging),可進行活細胞跟蹤。
4.離子成像(Ion imaging)/比率成像(Ratio imaging),可進行Ca2+,Mg2+,H+,Na+,K+,Zn2+,Ni2+,Fe2+,Hg2+,Pb2+及Cd2+等成像。
5.螢光原位雜交(FISH:fluorescence in situ hybridization);
6.螢光漂白恢復(FRAP:fluorescence recovery after photobleaching);
7.螢光共振能量轉移(FRETM:fluorescence resonance energy transfer;
8.光生命期成像顯微術(FLIM:fluorescence lifetime imaging microscopy)。
9.螢光相關光譜(FCS:fluorescence correlation spectroscopy)。