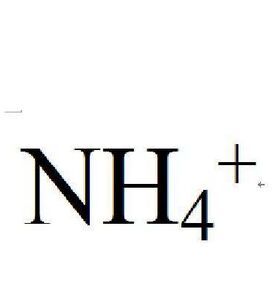
簡介
銨離子是正四面體型的,與甲烷互為等電子體。
存在
酸性環境下,溶解在水中的氨分子以銨根離子的形式存在。氨水可電離出銨根離子和氫氧根離子,濃氨水容易揮發為氨氣。液氨自耦電離能產生銨離子。
銨鹽
銨根離子還可以和陰離子結合形成鹽,大部分銨鹽都可溶(如矽酸銨溶於水會雙水解)。
常見的銨鹽有:
氯化銨 硝酸銨 碳酸氫銨 一般的銨鹽命名為某化銨或某酸銨,如氯化銨、醋酸銨等。
用途
用於銨鹽中含氮,鹽可用作氮肥,稱為銨態氮肥。此類肥料不宜與鹼性肥料混用,否則銨離子會被反應掉從而肥效降低。
常見的銨態氮肥有:
硫銨 碳銨 硝銨
檢驗
銨鹽的檢驗方法通常是與鹼混合(必要時加熱),會放出氨氣。
原理是銨鹽與鹼發生複分解反應,生成新鹽和氫氧化銨,氫氧化銨易揮發為氨氣和水。
NH4+OH−=NH3↑+H2O
檢驗銨根離子是在有銨根離子的試管中加入可溶性的鹼(鹼和鹽反應要求兩者都可溶,否則不反應,通常用的有氫氧化鈉/鉀/鈣/鋇等),然後加熱試管.再將濕潤的紅色石蕊試紙放在試管口,放出的氣體(鹼性氣體)能使濕潤的紅色石蕊試紙變藍,並可聞到氨氣味,則可說明其中有銨根離子。
如是硝酸銨:則NH4NO3與氫氧化鈉或熟石灰(Ca(OH)2)反應:
NH4NO3 + NaOH == NH3↑ + NaNO3 + H2O ( 加熱條件要標明)
2NH4NO3 + Ca(OH)2 == 2NH3↑ +Ca(NO3)2 +2H2O ( 加熱條件要標明)
對於碳銨
要區別碳銨於其他的銨鹽,可以通過加熱的方式。
NH4HCO3=(加熱)NH3↑+H2O+CO2↑
但請注意:這個方法最好不要用於鑑別硝酸銨和碳酸氫銨,因為硝酸銨遇高溫容易發生爆炸。
衍生物
季銨鹽,即NH4+的4個氫均被烴基取代的產物。
註解
^ 即硫酸銨,化學式(NH4)2SO4 ^ 即碳酸氫銨,化學式NH4HCO3 ^ 即硝酸銨,化學式NH4NO3 ^ 例如:NH4HCO3+Ca(OH)2=CaCO3+2H2O+NH3↑(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑
銨根離子
銨根的化合價是+1,故離子數為+1