簡介
【拼音】 ǎn (第十版 新華字典第五頁)gēn
【 化學式】NH4
【離子化學式】NH4+
【 性質】溶於水呈弱酸性
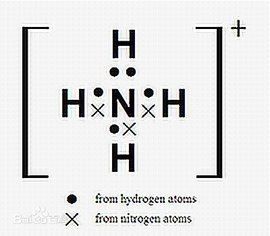
【立體構型】正四面體型,與甲烷互為 等電子體。
【釋義】是由 氨分子衍生出的正價 離子。氨 分子得到一個 質子就形成 銨離子。由於化學性質類似於 金屬離子,故命名為“銨”,屬於 原子團
【相關】遇 氫氧根(OH-)易生成 氨氣(NH3)和 水
NH4+ + OH- = NH3↑ + H2O
銨鹽一般為易溶於水的白色晶體,可用做肥料。
【 相對分子質量】14+1×4=18
銨根一般被視為金屬離子。
銨鹽的性質
皆為晶體,易溶於水,常伴有吸熱現象。在 水溶液中 水解一般呈弱酸性(除某些弱酸Ka值≤氨的Kb值的銨鹽,例如醋酸銨、氰化銨等)。
加熱則出NH3,是銨鹽的重要檢驗方法之一。 熱分解情況與對應的酸有關。一般 非氧化性酸的銨鹽熱分解產物為NH3與對應酸,如NH4Cl,NH4Br,(NH4)3PO4等。 氧化性酸的銨鹽熱分解比較複雜,產物有N2或其 氧化物出現,如:
NH4NO3 N2O+2H2O
NH4NO2 N2+2H2O
(NH4)2Cr2O7 N2+Cr2O3+4H2O
強酸銨鹽與弱酸銨鹽相比,弱酸銨鹽的穩定性差,如(NH4)2CO3在常溫就緩慢分解成NH3、CO2和 水蒸氣而損失
銨鹽的鹼解
銨鹽會和強鹼溶液在加熱條件下反應生成NH3,離子方程如下:
NH4+ + OH- === NH3 + H2O
一般使用NH4Cl和NaOH
NH4Cl + NaOH === NH3 + H20 + NaCl