金屬的氧化和熱腐蝕
正文
狹義的金屬氧化指金屬與氧化合成為氧化物的過程,即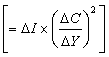 。廣義的金屬氧化指金屬失去電子從而正原子價升高的過程,即Μ=Mn++ne。金屬的氧化能否發生,取決於熱力學條件(見還原-氧化反應、氧勢圖)。
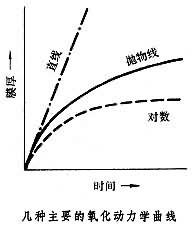
。廣義的金屬氧化指金屬失去電子從而正原子價升高的過程,即Μ=Mn++ne。金屬的氧化能否發生,取決於熱力學條件(見還原-氧化反應、氧勢圖)。 金屬的氧化膜 金屬氧化在金屬表面生成的覆蓋物,稱為氧化膜。在金屬氧化的初始階段,膜的增厚與時間常呈線性關係。達一定程度後,膜如果有裂紋,或疏鬆多孔,則無保護性,金屬的氧化繼續進行,膜的增厚曲線保持原來的直線形;膜如果比較緻密,具有一定的保護性,氧化受到阻滯,膜的增厚曲線轉為拋物線形;膜如果非常緻密,便具有良好的保護性,氧化基本停止,膜的增厚曲線轉為對數曲線形(見圖)。在溫度升高的情況下,化學反應以及金屬和氧通過膜的擴散均將加速,氧化也就會加速。鈀、銀、汞等金屬的氧化物由於熱力學上的不穩定,在高溫下會分解。環境氣氛中含有水蒸氣或硫化物時,導致加速氧化,尤以硫化物為嚴重,常稱這種情況為硫化腐蝕。
 金屬的氧化和熱腐蝕
金屬的氧化和熱腐蝕絕大多數的金屬氧化物是非化學計量關係的化合物。有許多是金屬離子不足的(點陣中有陽離子空位,如Cu2O,NiO),也有一些是金屬離子過剩的(點陣中有間隙金屬離子或陰離子空位,如ZnO),前者稱為p型,後者稱為n 型。膜的點陣中存在缺陷有利於金屬和氧通過膜進行擴散,因而有利於氧化的進行。一般說來,當氧的分壓增高時,p型的電導率和氧化速度增加,而n型的電導率和氧化速度減小。
合金的氧化 目前根據合金的成分還難以定量地推測它的氧化行為。但從熱力學觀點來看,氧化物的吉氏自由能更負的合金元素會先氧化。
如果在合金中氧的擴散比合金元素的擴散快,則合金中可能生成顆粒狀氧化物,這種現象稱為內氧化;晶界的氧化也屬於內氧化範疇。
如果合金基本元素的氧化物為p型,加入少量原子價較低的合金元素常能阻滯氧化,而加入少量原子價較高的元素常能加速氧化;如這種氧化物為n型,則效果正好相反。這一規律稱為豪費(Hauffe)定律。
熱腐蝕 在高溫和熔融的沉積物下,氧和其他腐蝕性氣體同時作用,產生的腐蝕稱為熱腐蝕。例如高溫合金在高溫含硫和鹽的燃氣中所發生的腐蝕。在這種情況下,金屬腐蝕生成的硫化膜疏鬆多孔或有裂紋,硫化物的晶體缺陷濃度較大,有利於金屬、氧和硫通過膜進行擴散,而且金屬硫化物的熔點較低,容易生成熔點更低的金屬-金屬硫化物共晶 (例如Ni3S2熔點為 787℃,而Ni-Ni3S2共晶熔點只有645℃),基於上述原因,熱腐蝕常比單純的高溫氧化嚴重得多。如果氣氛中含有釩、鉬等元素,由於V2O3的熔點僅674℃,MoO3在高溫下易於揮發,會造成“災害性”高溫腐蝕。
防止措施 主要有:①調整合金成分。目的是形成緻密氧化膜,提高合金的抗氧化能力。加入的合金元素的皮林-貝德沃斯比值(VMO/VM)應大於1。合金元素的吉氏自由能應較基體金屬為負,能先氧化。合金元素應根據豪費定律選擇。為了提高抗熱腐蝕能力,常加入的合金元素通常為鉻、鋁、鈦和稀土,其中鉻和少量稀土的作用已得到公認,對於鋁和鈦的作用還有爭議。②外加保護層。採用滲鋁、滲鉻、滲矽或鉻-鋁、鋁-矽等多元共滲等化學熱處理工藝,使工件的表層合金化;或濺射、熔焊、包鍍耐蝕合金,形成耐蝕表面。新發展起來的覆護層Μ-Cr-Al-Y合金對表面保護尤為有效。此外,為提高抗熱腐蝕能力也有採用高溫陶瓷塗層的。③改變環境介質條件。如採用控制氣氛以防止氧化,進行燃料脫鹽和脫硫等措施防止熱腐蝕。