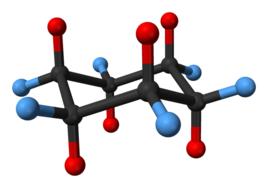
定義
重疊張力(torsional strain)是構象分析中的一種術語。乙烷在常溫下存在交叉式與重疊式兩種極限構象,前者較後者內能低而穩定,因而後者極易轉變為前者,這種分子內在的轉變力稱為重疊張力。
有機分子中任何像乙烷的部分,要像乙烷那樣採取交叉式構象才穩定,任何偏離交叉式構象的排飾都會產生向交又式溝象轉變的扭轉張力。例如在環己烷的船式構象中,就存在扭轉張力,易轉變為椅式構象。重疊張力屬於扭轉張力。
相關概念
空間張力=成鍵張力(單鍵伸長或縮短)+鍵角張力+扭轉張力+非鍵張力
分子內張力是上述四種張力之和。
1、 角張力(亦稱Baeger張力):它是由於正常鍵角改變產生的。
2、 鍵張力:是由鍵的伸縮使正常鍵長改變而產生的張力。
3、扭轉張力(pitzer張力):它是由於優勢構象二面角改變而產生的張力。兩個連線四面體碳原子,他們都傾向於成為交叉式,與交叉式任何偏差都會引起一定張力,希望恢復到交叉式的最穩狀態,這種張力就是扭轉張力。
4、非鍵張力(范德華張力):非鍵合的原子或基團相互作用。
在小環化合物中(3~4元環)主要存在有角張力;普通環(5~7元環)各種張力都不顯著,6元環無角張力、無扭轉張力。 在中環(8~11元環)主要存有跨環張力。在大部分環狀化合物中(除大環外)大部分存在扭轉張力。
單鍵旋轉時,相鄰碳上的其他鍵會交叉成一定的角度,稱為扭轉角(torsion angle)。扭轉角是0°的構象為重疊構象,扭轉角是180°的構象為反錯構象,扭轉角是60°的構象是鄰位交叉構象,也叫順錯構象,扭轉角在0-60°之間的構象為扭曲構象(skewedconformation)。
構象和構象分析
構象:沿C-C單鍵旋轉,分子產生不同形象,稱為構象。
單鍵旋轉能壘一般為3~10千卡/摩爾,在室溫下熱運動可以越過此能壘,各種構象迅速互變,分子在某一構象停留時間很短(﹤10-6秒),因此不可能將某一個構象分離出來。
研究構象對於了解化合物結構、反應歷程和反應取向等方面非常重要。 許多分子呈現有張力,就是由於非理想幾何形狀造成的。分子將儘可能利用鍵角或鍵長的改變使能量達到最低值,就是說一個分子總是要採取使其能量為最低的幾何形狀。
丁烷的構象
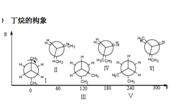 重疊張力
重疊張力Ⅰ對位交叉,Ⅱ部分重疊,Ⅲ鄰位交叉,Ⅳ全重疊式,Ⅴ鄰位交叉,Ⅵ部分重疊,Ⅰ為優勢構象
從丁烷的勢能圖可見,有三個能量極大值,全重疊式為最大值;三個能量極小值,對位交叉為最小值。
穩定性次序:對位交叉﹥鄰位交叉﹥部分重疊﹥全重疊
兩個鄰位交叉Ⅲ、Ⅴ比對位交叉式略高0.8kcal/mol,是由於甲基之間的排斥作用,但由於能量相差不大,在室溫下,兩者都可存在。對位交叉占68%,鄰位交叉占32%。正丁烷體系不能分離出單一的構象異構體,他們這類化合物的性質是各種構象異構體的平均值。
環己烷構象
環己烷構象(cyclohexane conformation),可分椅式(chair)、船式(boat)、扭船式以及半椅式。
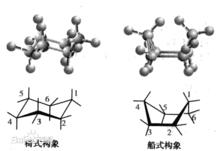 重疊張力
重疊張力若環己烷分子中碳原子在同一平面上時,其C—C鍵角為120度,存在較大的角張力。實際上分子自動折曲而形成非平面的構象,在一系列構象的動態平衡中,椅式構象(chair conformation)和船式構象(boat conform ation)是兩種典型的構象。在常溫下,由於分子的熱運動可使船式和椅式兩種構象互相轉變,因此不能拆分環己烷的船式或府式中的某一種構象異構體。
構象對化學反應速度的影響
(1) 酯的水解
反式比順式在鹼性條件下水解快20倍。 鹼性、酸性水解,四面體機制。 鹼性水解條件下,HO-進攻羰基碳。在反式酯中,形成過渡態中,空間比較寬敞,有利。而在順式酯形成的過渡態中,雙1,3相互排斥,過於擁擠,不利。
(2)環己酮的還原
用LiAlH4-t-BuOH、NaBH、Na醇等作為還原劑時,真正的還原劑H-體積小,從羰基兩側進攻機會相當,由於e醇比較穩定,反應受“產物生成控制”。此時a 9%,e 91%。如果還原劑為或BH(CHMeCHMe2)2,其體積比較大,則產物以a-OH為主,反應受“立體途徑控制”。
構象對分子物化性質的影響
分子的構象不僅影響化合物的物理和化學性質,而且還對一些生物大分子(如蛋白質、酶、核酸)的結構和性能產生影響。許多藥物分子的構象異構與藥物生物活性密切相關,藥物受體一般只與藥物多種構象中的一種結合,這種構象稱為藥效構象。藥物的非藥效構象異構體很難與藥物的受體結合,通常低效或無藥效。例如,抗篾顫麻痹藥物多巴胺作用於受體的藥效構象是對位交叉式。