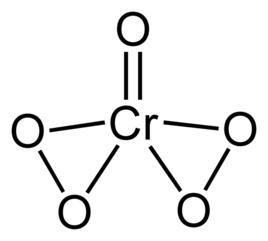
化學性質
過氧化鉻中有兩個過氧鍵—O—O—。
過氧化鉻不穩定,易溶於酸並分解放出氧氣,生成鉻(III)鹽(綠色)。
4CrO5+6H2SO4====2Cr2(SO4)3+7O2(g)+6H2O
過氧化鉻屬於酸性氧化物,溶於水生成過鉻酸,溶於過氧化氫生成過鉻酸:
2CrO5 + H2O ==== H2Cr2O11
2CrO5 +3H2O2====2H3CrO8
易溶於酸性過氧化氫並分解放出氧氣,生成鉻(III)鹽(綠色):
2CrO5+3H2SO4+7H2O2====Cr2(SO4)3+7O2(g)+10H2O
過氧化鉻在中性或鹼性溶液中較穩定,形成穩定的過鉻酸鹽,在酸性溶液中緩慢分解。
2CrO5 +3H2O2+ 6NaOH ==== 2Na3CrO8 + 6H2O
2CrO5+2NaOH====Na2Cr2O11+ H2O
4CrO5+6H2SO4====2Cr2(SO4)3+7O2(g)+6H2O
過氧化鉻有強氧化性:
12CrO5+4FeO====2Fe2(Cr2O11)3+5O2(g)
過氧鍵配位,但在乙醚中,過氧鍵與鉻形成π配鍵、乙醚中氧去和鉻配位,形成八面體。
製取
製備方式:酸性重鉻酸鉀加過氧化氫。
先用硫酸酸化鉻酸或重鉻酸鹽水溶液,然後加過氧化氫,得藍色結晶過氧化鉻(CrO5):
K2Cr2O7+4H2O2+H2SO4====2CrO5+K2SO4+5H2O(該反應也可檢驗H2O2)
為增加其穩定性,反應須在冷水中進行, 並用乙醚等有機溶劑萃取.