製備加工
1.收集10ml全血,加入30ml細胞裂解液。置冰浴中至少20min直至紅細胞完全溶解。
2.2000r/min離心10min,移去紅色上清液,再次用細胞裂解液洗滌細胞,然後用PBS重懸細胞。
3.稀釋單細胞懸液並取一小份用Neubauer腔計數細胞。
4.用PBS重懸細胞,以達到40μl PBS中含1百萬個細胞比例(1百萬個二倍體哺乳動物細胞中大約含有基因組DNA 10μg)
5.用PBS配製2%濃度低熔點瓊脂糖溶液並保持在50℃。
6.將等體積(各1ml)細胞懸液與瓊脂糖溶液於室溫下混勻,立即倒入凝膠塊模具中。
7.靜置20min讓瓊脂糖固化,用無菌塑膠杯(通常用作劃菌)將凝膠塊自模具中取出並置入蛋白酶緩衝液中,加入2mg/ml的蛋白酶K。
8.將帶有凝膠塊的蛋白酶K緩衝液於50℃保持2~3天。每個盛有50ml蛋白酶緩衝液的Falcon管可容納多達100個凝膠塊。
9.蛋白酶K消化後,可將凝膠塊保留在此緩衝液或0.5mol/L EDTA溶液中保存於4℃。
10. 此外,繼續將凝膠塊用高壓消毒過的TE緩衝液沖洗數遍的步驟。
11. 將凝膠塊放入裝有TE及0.04mg/mlPMSF溶液的Falcon試管中,滅活殘留的蛋白酶K。
12. 室溫下用TE溶液漂洗凝膠塊數次,將凝膠塊放入另一乾淨的試管,可直接用於酶切反應或用0.5mol/L
EDTA,(pH8.0)4℃保存凝膠塊。
13. 若用EDTA保存凝膠塊,取出後套用TE溶液室溫下漂洗30 min×2次。
標準物
λ多聯體
1.以TE緩衝液懸浮λ多聯體(Boehringer MA寶靈曼公司產品),濃度為4μg/40μl。
2.用等體積TE配製的2%低熔點瓊脂糖(溫度保持在45℃)混勻。
3.移去混合液注入預冷的凝膠塊模具中。
4.室溫下用TE及100 mmol/L NaCl溶液溫育2天。
酵母染色體
1.從YPD(酵母提取物,蛋白腖和葡萄糖)培養基瓶皿中挑選單一克隆加入10ml
YPD預培養的肉湯中,30℃下劇烈震盪生長24小時,然後加入200ml YPD肉湯,劇烈振盪24~48h(產量大約100塊)。
2.4000×g轉速,離心10min,然後用50mmol/L EDTA/10 mmol/L Tris-HCl(pH7.5)溶液懸浮。
3.仍以4000×g轉速離心10min,再用SCE[1 mol/L 山梨醇,0.1mol/L枸椽酸鈉,pH5.8及10 mmol/L
EDTA (pH7.5)]溶液重懸。
4.取稀釋後的細胞懸液用Neubauer腔計數。
5.溶液短暫離心後,再用SCE重懸細胞,使40μl SCE溶液中含5×107個細胞(相當於80μl體積的模組中含有5×107個細胞)。
6.溶液與0.1mg/ml酵母扣糖酶100T和100mmol/Lβ-巰基乙醇混勻,37℃保溫15~30min。
7.細胞懸液與等體積的SCE配製的2%低熔點瓊脂糖凝膠混勻,保持在50℃。
8.將混合物移注入預冷的凝膠塊模具中。
9.凝膠塊用含10 mmol/L二硫蘇糖醇的SCE溶液37℃下振盪溫育1~2小時。
10. 將凝膠塊移入蛋白酶緩衝液中,加入2mg/ml蛋白酶K,50℃溫育48h。
11. 用50 mmol/L EDTA/10 mmol/L Tris-HCl(pH7.5)溶液洗滌凝膠塊3次,每次20min。
12. 凝膠塊可用此混合液於4℃保存或不用漂洗直接裝載入凝膠中。
內切酶
1.應使用消毒溶液及戴無菌手套以免DNA降解。
2.在Falcon試管中用1×TE溶液漂洗凝膠塊20min 3次,以去除EDTA。
3.混合:酶反應緩衝液(高、中或低鹽緩衝液),100
mmol/L亞精胺(只用於高鹽緩衝液狀態),10~20單位的內切酶。20單位的內切酶就足以過夜完全消化10μg DNA。
4.設立一個除內切酶成分外含有混合物各組分的陰性對照,以檢查是否有非特異性DNA降解。
5.將瓊脂糖凝膠塊加入反應混合溶液中:通常用消毒過的手術刀或套環將凝膠塊移入。
6.若兩種內切酶所需緩衝液條件一致,可以同時或先後用兩種不同的酶進行消化(先用低鹽緩衝液的酶消化,再調整鹽濃度)。倘若首次消化的酶要求50℃條件,在第二個酶消化時要換緩衝液。
7.若要進行部分消化,則首先在同一溫度和反應時間用1:10稀釋的酶進行嘗試。
凝膠電泳
1.將0.8%的瓊脂糖在0.25×TBE中熔化後冷卻至50~60℃,立即注入凝膠框架中,並插入梳子。
2.凝膠固化後小心地拔出齒梳,用2把無菌手術刀將DNA凝膠塊上樣。若用不同內切酶消化凝膠塊,則取不同樣品時應將手術刀片燒灼後冷卻。將DNA大小標誌物上樣至凝膠的兩旁。
3.用1%液態低熔點瓊脂糖凝膠(0.25×TBE配製)密封狹槽。
4.若有氣泡存在,用注射器驅趕氣泡。
5.一旦密封的低熔點瓊脂糖已固化(大約10min),可將凝膠擱入腔室,並用電泳緩衝液覆蓋過膠面。
6.應設定合適的電壓及轉換時間(參考《分子醫學技術》84頁表8.1)並開始電泳。兩個不同電泳方向的電流應相等。
7.電泳結束後,凝膠用0.25×TBE配製成的EB(0.4μg/ml)染色。
8.用泵自槽中排除緩衝液,續以雙蒸水沖洗電泳槽。
9.凝膠成像:DNA在曝光的過程中可能會形成缺口。
10. 用0.25mol/L HCl漂洗凝膠30min,讓DNA脫嘌呤,並有利於轉移。
11. 凝膠用鹼(變性溶液中)變性20min,兩次,續以中性溶液1~5min。
12. 採用標準Southern印跡方案將DNA轉印至尼龍膜上。一般來說,印跡PFGE凝膠的時間較普通凝膠印跡時間長(約48h)。
PFGE'S Agarose
一、InCert瓊脂糖----兆鹼基片斷DNA製備獲準使用的瓊脂糖。是一種極為有用的製備脈衝場凝膠電泳用染色體DNA樣品的低膠凝溫度瓊脂糖。研究證實InCert瓊脂糖凝膠可支持凝膠中染色體DNA的製備和限制性核酸內切酶消化。
⊙套用:脈衝場凝膠電泳。
⊙分析說明:膠凝溫度(1.5%):26℃-30℃
硫酸鹽:≤0.15% 凝膠強度(1.0%:≥400g/cm2
熔化溫度(1.5%):≤70℃
濕度:≤10%
EEO(-Mr):≤0.10
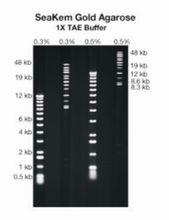 LONZA公司 SeaKem Gold瓊脂糖
LONZA公司 SeaKem Gold瓊脂糖二、SeaKem Gold瓊脂糖是一種高凝膠強度,低EEO,標準膠凝溫度的瓊脂糖。這種遺傳學術級別(Genetic Technology Grade,GTG)瓊脂糖最適於脈衝場凝膠電泳法(pulsed field gel electrophoresis,PFGE)快速分辨Mb(megabase))50kb-10Mb)DNA和常規電泳方法分辨1-50kb的DNA與PCR產物。因其低EEO特性,SeaKem Gold瓊脂糖中的DNA電泳遷移速度要顯著的高於常規瓊脂糖凝膠。PFGE的跑膠時間依使用的緩衝液和瓊脂糖濃度的不同可減少至原電泳時間的50%。因其高凝膠強度,即使是使用低濃度(0.5%)的SeaKem Gold瓊脂糖凝膠,操作處理依然很方便,從而允許在常規電泳中分離更大的DNA片斷並減少PFGE中的DNA分離的耗時。
⊙套用:脈衝場凝膠電泳; 標準凝膠電泳分離大於23kb的DNA片斷;Mb大小DNA印跡。
⊙分析說明:
膠凝溫度(1.5%):34.5℃-37.5℃
硫酸鹽:≤0.10%
凝膠強度(1.0%):≥1800g/cm2
凝膠強度(1.5%):≥3500g/cm2
濕度:≤10% EEO(-Mr):≤0.05
![脈衝場凝膠電泳[簡介] 脈衝場凝膠電泳[簡介]](/img/5/410/nBnauM3X1QTN1IDN5EDMzUTN1UTM1QDN5MjM5ADMwAjMwUzLxAzLyMzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg)
