羰基鐵
正文
鐵與一氧化碳的化合物,有單核、雙核以至多核等形式,還可以是一氧化碳與氫負離子、鹵素離子、氧化氮等其他配體的混合配體的配位化合物,如 Fe(CO)5、Fe2(CO)9、Fe3(CO)12、H2Fe(CO)4、H2Fe2(CO)8、H2Fe3(CO)11、Fe(CO)4(NO)、Fe(CO)4Cl2 、Fe2(CO)8I2。大多數多核配合物以一個或幾個一氧化碳為橋相聯結,也有以鹵素或其他配體為橋的,還常存在鐵與鐵之間的金屬鍵,所以有時也是原子簇金屬化合物。比較常見的羰基鐵有以下三種:五羰基鐵 化學式為Fe(CO)5。為黃色油狀液體;熔點-21℃,沸點102.8℃,液體密度1.457克/厘米3(21℃);250℃分解得純鐵;不溶於水,溶於鹼、濃硫酸、醇、苯和石油醚。Fe(CO)5受日光或紫外線照射時發生二聚作用,生成Fe2(CO)9和一氧化碳。五羰基鐵的乙醚溶液與礦酸作用,分解成一氧化碳、氫氣和二價鐵。強鹼的水溶液或灑精溶液可將Fe(CO)5轉化成【HFe(CO)4】-陰離子。五羰基鐵在丙酮溶液中可被氯化銅氧化成二價鐵。六氯化鎢與五羰基鐵作用,生成六羰基鎢。Fe(CO)5中的一氧化碳可與許多配體發生取代反應。生成混合配體配合物Fe(CO)xLy,式中L為PR3、AsR3、烯烴或硫原子等(R為烷基)。
五羰基鐵由細鐵粉與一氧化碳在200℃左右和 50~200大氣壓下直接反應製得。可用於有機合成,用作抗爆劑、脫鹵和羰基化試劑。
九羰基二鐵 化學式為Fe2(CO)9,結構式如
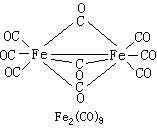 。為黃色晶體;密度2.085克/厘米3(18℃);80℃時分解,高真空下35℃時可升華;有反磁性;不溶於水、醇、酸和脂肪烴類溶劑。九羰基二鐵與許多有機溶劑反應,生成 Fe(CO)5或其取代衍生物;在液氨中與金屬鈉反應生成Fe(CO)娸陰離子:
。為黃色晶體;密度2.085克/厘米3(18℃);80℃時分解,高真空下35℃時可升華;有反磁性;不溶於水、醇、酸和脂肪烴類溶劑。九羰基二鐵與許多有機溶劑反應,生成 Fe(CO)5或其取代衍生物;在液氨中與金屬鈉反應生成Fe(CO)娸陰離子: Fe2(CO)9+4Na─→2Na2Fe(CO)4+CO
也容易發生取代反應,在液態二氧化硫中可生成Fe2(CO)8SO2, 其中SO2也是兩個鐵原子間的橋聯配體。九羰基二鐵由 Fe(CO)5的有機溶劑溶液經日光或紫外線的照射製得。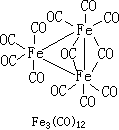
3Fe3(CO)12+nCH3OH─→
【Fe(CH3OH)n】【Fe3(CO)11】+5Fe(CO)5
