簡述
線型縮聚反應機理
強酸(HA)催化的聚酯化反應機理大致包括兩個過程:
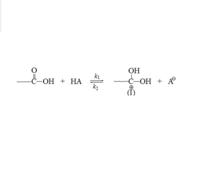 圖一:反應機理
圖一:反應機理⑴羧酸質子化生成質子化種(Ⅰ):如圖一
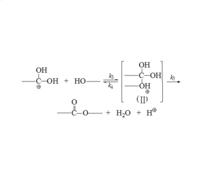 圖二:反應機理
圖二:反應機理⑵ 質子化種(Ⅰ)與醇反應,經過過渡狀態(Ⅱ)生成酯:如圖二
線型縮聚物相對分子質量的控制
我們知道聚合物的相對分子質量是表征聚合物性能的重要指標之一。PET(聚酯)相對分子質量在2.1萬~2.3萬才具有較高的強度和可紡性;PC(聚碳酸酯)的相對分子質量要在2萬~8萬才能做為工程塑膠。因此,合成指定相對分子質量的聚合物是一個很重要的問題。利用控制反應程度、平衡常數、反應時間來控制相對分子質量的方法並非有效。n有效的方法是相對分子質量穩定化法。 n指當聚合物相對分子質量達到要求時,加入官能團封鎖劑,使縮聚物兩端官能團失去再反應的能力,從而達到控制縮聚物相對分子質量的目的。
在混縮聚體系中控制縮聚物分子量的方法:在混縮聚體系中(a-R-a,b-R’-b),官能團非等物質的量投料,利用過量的那種單體,作為官能團封鎖劑,進行官能團封鎖,控制縮聚物相對分子質量。縮聚物的平均聚合度與官能團物質的量的關係:
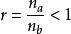 線性合成
線性合成設t=0時,官能團a物質的量為n,官能團b物質的量為n,且n<n並令:
 圖三:推理過程
圖三:推理過程r-稱為官能團a物質的量與官能團b物質的量之比;令t 時刻官能團a的反應程度為P,t 時刻官能團b的反應程度為rP;於是t 時刻,官能團a物質的量為n(1-P),t 時刻,官能團b物質的量為n(1-rP)。
推理過程如右圖三:
重要的線型縮聚物的合成
工業上滌綸樹脂的合成
滌綸是聚酯的重要代表,它是重要的合成纖維和工程塑膠。合成滌綸的原料是乙二醇和對苯二甲酸。當原料純度很高時,可以用直縮法製備滌綸樹脂。在原料純度不很高的情況下,很難控制官能團物質的量,需用酯交換法製備滌綸樹脂。工業上生產滌綸比較成熟的方法是酯交換法。即先將對-苯二甲酸與甲醇反應生成對-苯二甲酸二甲酯——甲酯化 。然後將對-苯二甲酸二甲酯與乙二醇反應生成對-苯二甲酸二乙二醇酯——酯交換 , 再以對-苯二甲酸二乙二醇酯為單體進行均縮聚,製備聚對-苯二甲酸二乙二醇酯(PET)——滌綸樹脂。
合成滌綸樹酯有關的化學反應原理如下:
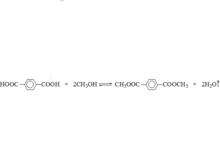 圖四:反應式
圖四:反應式1、對-苯二甲酸甲酯化 :酸催化,對-苯二甲酸與甲醇酯化製備對苯-二甲酸二甲酯。特別注意將苯甲酸一類單官能團化合物除盡 。 反應式如圖四:
2、酯交換:在150℃~200℃下,使對-苯二甲酸二甲酯與乙二醇進行酯交換製備對-苯二甲酸二乙二醇酯。反應式如圖五:
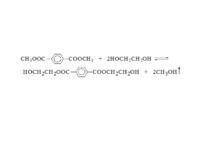 圖五:反應式
圖五:反應式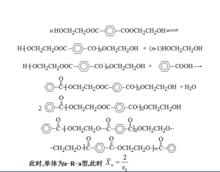 圖六:反應式
圖六:反應式3、 滌綸樹脂的合成 :以三氧化二銻為催化劑,以對-苯二甲酸二乙二醇酯為單體進行均縮聚。為了控制縮聚物的相對分子質量加入單官能團化合物苯甲酸做官能團封鎖劑。反應式如圖六:
聚酯化反應的平衡常數較小,K=4,縮聚反應的速度較低需要加催化劑,反應需在高溫和高真空條件下進行,聚合體系始終保持熔融狀態。 縮聚反應先在220℃、壓力20kPa條件下進行進行預縮聚, 再於260℃~270 ℃、壓力600Pa條件下進行縮聚,最後在280℃~285℃、壓力 67Pa~133Pa和條件下完成縮聚。
聚醯胺的合成
 圖七:反應式
圖七:反應式聚醯胺有兩類。一類由二元胺和二元酸合成,如尼龍-66, 尼龍-610,尼龍-1010等;另一類是由胺基酸或已內醯胺開環聚合而成,如尼龍-6。尼龍-66是聚醯胺的最重要品種,合成尼龍-66原料是己二胺和己二酸。通過二元胺和二元酸的中和形成“66”鹽的方法來達到兩官能團等物質的量。 工業上合成尼龍-66的有關化學反應原理如下: 1、 製備“66”鹽並精製,反應式如圖七:
2、測定“66”鹽的酸值
酸值:用KOH標準溶液(醇溶液)滴定“66”鹽,每克“66”鹽所消耗的KOH的毫克數,mg KOH/g“66”鹽。
 圖八
圖八通過測定“66”鹽的酸值,可以預測尼龍-66的相對分子質量。預測數值如圖八:
3、尼龍-66的合成
將已提純的“66”鹽水溶液提濃至60%,在密閉的系統內,加熱215℃,1.5h~2h,借水的蒸氣壓保持壓力1.8 MPa ,再升溫至250℃,此階段進行水溶液縮聚,“66”鹽經初步縮聚後形成低聚體。然後再降壓至常壓,保持溫度270℃~275℃,水分大部分蒸發,聚合物平均聚合度增加,再升溫至280℃,壓力降至3kPa,此階段進行熔融縮聚,反應一段時間, 結束反應。
聚酯化反應和聚醯胺化反應比較
聚酯化反應平衡常數小,反應需在高溫和高真空條件下進行,需要加催化劑,聚合體系始終保持熔融狀態。聚醯胺化反應平衡常數較大,前期進行水溶液縮聚,後期轉入熔融縮聚,所要求的真空度並不像合成聚酯時那樣高、不需要加催化劑,就可達到所要求的相對分子質量。

