原理
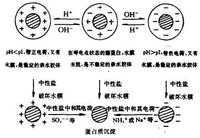 等電點沉澱法
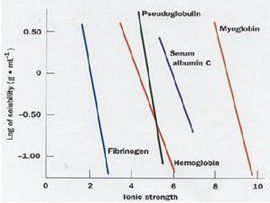
等電點沉澱法在等電點時,蛋白質分子以兩性離子形式存在,其分子淨電荷為零(即正負電荷相等),此時蛋白質分子顆粒在溶液中因沒有相同電荷的相互排斥,分子相互之間的作用力減弱,其顆粒極易碰撞、凝聚而產生沉澱,所以蛋白質在等電點時,其溶解度最小,最易形成沉澱物。等電點時的許多物理性質如黏度、膨脹性、滲透壓等都變小,從而有利於懸浮液的過濾。
注意
1.不同的蛋白質,具有不同的等電點。在生產過程中應根據分離要求,除去目的產物之外的雜蛋白;若目的產物也是蛋白質,且等電點較高時,可先除去低於等電點的雜蛋白,如細胞色素C的等電點為10.7,在細胞色素C的提取純化過程中,調pH=6.0除去酸性蛋白,調pH=7.5~8.0,除去鹼性蛋白。 2.同一種蛋白質在不同條件下,等電點不同。在鹽溶液中,蛋白質若結合較多的陽離子,則等電點的pH值升高;因為結合陽離子後,正電荷相對增多,只有pH值升高才能達到等電點狀態,如胰島素在水溶液中的等電點為5.3,在含一定濃鋅鹽的水—丙酮溶液中的等電點為6;如果改變鋅鹽的濃度,等電點也會改變。蛋白質若結合較多的陰離子(如C1-、SO42-等),則等電點移向較低的pH值,因為負電荷相對增多了,只有降低pH值才能達到等電點狀態。 3.目的藥物成分對pH值的要求。生產中應儘可能避免直接用強酸或強鹼調節pH值,以免局部過酸或過鹼,而引起目的藥物成分蛋白或酶的變性。另外,調節pH值所用的酸或鹼應與原溶液中的鹽或即將加入的鹽相適應,如溶液中含硫酸銨時,可用硫酸或氨水調pH值,如原溶液中含有氯化鈉時,可用鹽酸或氫氧化鈉調pH值。總之,應以儘量不增加新物質為原則。 4.由於各種蛋白質在等電點時,仍存在一定的溶解度,使沉澱不完全,而多數蛋白質的等電點又都十分接近,因此當單獨使用等點電沉澱法效果不理想時,可以考慮採用幾種方法結合來實現沉澱分離。