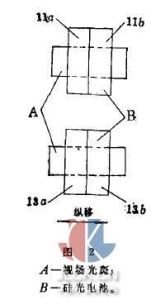
解釋
 莫爾法
莫爾法一種銀量沉澱滴定法,用鉻酸鉀做指示劑。
套用範圍
主要用於測定氯化物中的Clˉ和溴化物中的Brˉ
詳解
以K2CrO4為指示劑 (一)原理:以AgNO3標準溶液測定Cl-為例
終點前:Ag++Cl-=AgClˉ(白色)Ksp=1.8×10ˉ10
終點時:2Ag++CrO42-=Ag2CrO4ˉ(磚紅色)Ksp=2.0×10ˉ12
沉澱的溶解度S:SAgCl
1.34×10-5mol/L二甲基二碘螢光黃>Br->曙紅>Cl->螢光黃或二氯螢光黃
計量點附近終點出現的早晚與溶液中[CrO42-]有關:
[CrO42-]過大------終點提前------結果偏低(-TE%)
[CrO42-]過小-------終點推遲------結果偏高(+TE%)
(二)指示劑用量(CrO42-濃度)
理論計算:在計量點時,溶液中Ag+物質的量應等於Cl-物質的量
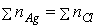 莫爾法
莫爾法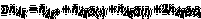 莫爾法
莫爾法(1)
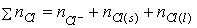 莫爾法
莫爾法(2)
(3) (2)、(3)代入(1)得
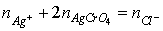 莫爾法
莫爾法(4) 若計量點時溶液的體積為100ml,實驗證明,在100ml溶液中,當能覺察到明顯的磚紅色Ag2CrO4ˉ出現時,需用去AgNO3物質的量為2.5×10-6mol,即:
 銀量法
銀量法實際滴定中:因為K2CrO4本身呈黃色,按[CrO42-]=5.9×10-2mol/L加入,則黃顏色太深而影響終點觀察,實驗中,採用K2CrO4濃度為2.6×10-3mol/L~5.6×10-3mol/L範圍比較理想。(計算可知此時引起的誤差TE<±0.1%)
在實驗中:50~100ml溶液中加入5%K2CrO41ml。
(三)滴定條件
1.溶液的酸度
通常溶液的酸度應控制在pH=6.5~10(中性或弱鹼性),
若酸度高,則:
Ag2CrO4+H=2Ag++HCrO4- Ka2=3.2×10-7
2HCrO4-?Cr2O72-+H2OK=98
若鹼性太強:2Ag++2OH-2AgOH=AgO↓+H2O
當溶液中有少量NH3存在時,則應控制在pH=6.5~7:
NH3++OH-NH3+H2O=Ag+Ag(NH3)2
2.沉澱的吸附現象 先生成的AgCl↓易吸附Cl-使溶液中[Cl-]↓,終點提前,滴定時必須劇烈搖動。AgBr↓吸附更強。
3.干擾離子的影響
①能與Ag+生成沉澱的陰離子(PO43-、AsO43-、SO32-、S2-、CO32-、C2O42-)
②能與Cr2O72-生成沉澱的陽離子(Pb2+、Ba2+)
③在弱鹼性條件下易水解的離子(Al3+、Fe3+、Bi3+)
④大量的有色離子(Co2+、Cu2+、Ni2+)都可能幹擾測定,應預先分離。