定義
稀溶液具有共同的性質規律,如溶液的蒸汽壓下降、沸點升高、凝固點下降和滲透壓等,它們與溶質的本性無關,由溶質粒子數目的多少決定,因此被稱為稀溶液的依數性。
分類
非電解質溶液的依數性
非電解質溶液中的溶質是以分子形式進入溶劑的,故其依數性很有規律,與溶液中所含溶質的粒子數(即分子數)密切相關。
1、蒸汽壓降低
從分子運動論的角度分析可知,液體的蒸氣壓就是液體和蒸氣建立平衡時的蒸氣壓力,它與單位時間裡由液面蒸發的分子數有關。由於加入少量難揮發的非電解質溶質,必然降低了單位體積溶液內所含可揮發溶劑分子的數目,溶液表面也會被部分難揮發的溶質所占據。因此單位時間內逸出液面的溶劑分子數相應減少,這樣蒸氣中含有較少的溶劑分子(氣相)即可與溶液(液相)處於平衡狀態,即形成了溶液蒸氣壓低於純溶劑蒸氣壓的狀態。同一溫下,純溶劑蒸氣壓與溶液蒸氣壓之差稱作溶液的蒸氣壓下降。
實驗結果表明,在一定溫度時,對於難揮發非電解質的稀溶液,其蒸氣壓下降值(ΔP)與溶質的摩爾分數成正比。
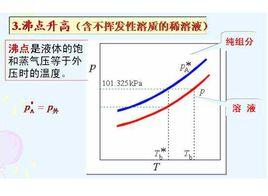
2、沸點上升
液體的沸點是液體的蒸氣壓等於外界壓力時的溫度。溶液由於蒸氣壓低於純水蒸氣壓,故在100℃時溶液蒸氣壓小於外界壓力,要想使溶液的蒸氣壓達到101. 3kPa,必須升高溫度,因而溶液的沸點高於純溶劑。溶液的沸點上升(△ Tb ) 與溶液的質量摩爾濃度m(1kg溶液中所含溶質的物質的量)成正比。
3、凝固點下降
物質的凝固點是其固態蒸氣壓等於液態蒸氣壓時的溫度,純水在0℃ 時結冰,凍的蒸氣壓等於水的蒸氣壓。 當難揮發性溶質溶於水形成溶液時,溶液的凝固點就是溶液中溶劑與純固態溶劑具有相同蒸氣壓時的溫度。因為溶液蒸氣壓下降,使得凍的蒸氣壓大於溶液蒸氣壓,冰、液不能共存。冰溶解,故溶液在0℃ 時不能結冰。 當溫度繼續降低時,由於冰隨溫度降低蒸氣壓下降的程度大, 溶液蒸氣壓下降的程度小, 在0℃ 以下的某溫度時,它們二者可達到相等。此時即為冰、液共存點,也就是此溶液的凝固點。它要比純溶劑(如水) 的凝固點低。溶液的凝固點下降(△ Tf ) 與溶液的質量摩爾濃度同樣是成正比關係。
4、溶液的滲透壓
半透膜具有選擇性的允許水或某些小分子透過,而不允許其他分子透過的性質。稀溶液在半透膜表面擴散速率大,濃溶液因為單位體積內溶劑分子數相應減少,溶劑分子在其表高擴散速率小, 結果是稀溶液中的水向濃溶液中滲透,使得濃溶液體積增大。當滲透作用達到平衡時,即半透膜兩邊溶液濃度相等時,半透膜兩邊的靜壓力差稱為滲透壓。一定溫度時,溶液越濃,產生的滲透壓越大。
電解質溶液的依數性
電解質溶液與非電解質溶液有所不同,它要複雜的多。因為當電解質物質溶於水時,由於電解質的種類不同,有可以全部電離成離子的強電解質,也有隻能部分電離成離子的弱電解質,它們在溶液中的粒子數、質量摩爾濃度等就不可能有一個統一的規律。電解質溶液的依數性,與非電解質溶液依數性的數學表達式大體相同,但考慮到上述原因,通常要加上一個係數i (范特荷夫係數)。
套用
大家熟悉的生理鹽水、葡萄糖注射液就是為了維持人體血管里紅細胞與周圍血漿正常的滲透壓,而特別配製成0. 9%、5% 的等滲溶液; 有時為了處理一些因大面積燒傷而嚴重脫水或因失鈉過多而血漿水分增多的特殊病人,也會相應使用低滲溶液或高滲溶液。滲透作用對生物的生命現象也有著十分重要的作用。
冬天汽車散熱器里使用的防凍劑,利用的就是凝固點下降的原理。
測定未知物質的相對分子質量通常也是利用稀溶液的依數性來完成的,其中凝固點下降法最為常用,並且較為準確。