簡介
短裸甲藻屬於裸甲藻目(Gymnodiniales),裸甲藻科(Gymnodiniaceae),裸甲藻屬(Gymnodinium)。短裸甲藻毒素(Brevetoxin,BTX)主要是由雙鞭甲藻(Karenia bravisbrevis)產生的一類赤潮藻毒素,其他藻類如劇毒岡比甲藻(Gambierdiscums toxincus)、褐胞藻(Chattonella)、卡盾氏藻(Chattonella antiqua)、海洋褐胞藻(Chattonella marina)、針胞藻(Fibrocapsa japonica)和赤潮異彎藻(Heterosigma akashiwo)等也可產生BTX。
此類毒素可富集到貝類等生物體中,並導致消費者產生諸如噁心、嘔吐、腹瀉、痙攣、支氣管收縮、麻痹、昏迷等神經性中毒症狀,因此也曾被廣泛稱為神經性貝毒(Neurotoxic Shellfish Poisoning,NSP)。不過,由於其他毒素如麻痹性貝毒(paralytic Shellfish Poisoning,PSP)也可以導致消費者出現神經性中毒症狀,所以原有的分類方法已不能滿足管理和科研的需求。因此,2004年由聯合國糧農組織、世界衛生組織和政府間海洋委員會共同組建的雙殼軟體生物毒素工作組,根據毒素的基本結構和化學性質對現有貝類毒素進行了重新分類,從而將原有的神經性貝毒命名為短裸甲藻毒素組毒素(Brevetoxin-group,BTX),簡稱為BTX毒素。產生該毒素的貝類主要分布在美洲墨西哥灣沿岸及紐西蘭豪拉基海灣等海域。
物化特性
化學性質從化學性質上來看,BTX屬於聚醚類的脂溶性藻類毒素(Lipophilic Phycotoxins,LPs),具熱穩定性,易溶解於甲醇、乙醚等非極性有機試劑,該特性導致這類毒素在貝類等生物體中的消除半衰期長達數十天甚至數月,且加熱、微波等常規加工方式因降低了水產品中的含水量而導致毒素濃度更高,因此這類毒素對消費者帶來的潛在危害更加嚴重。
BTX是無臭、無味、熱穩定的脂溶性聚醚類海洋生物毒素,具有獨特的結構和藥理功能。BTX難溶於中性及酸性水溶液,可溶於1%NaOH溶液和二硫化碳、氯仿、苯、乙醚、丙酮、甲醇、乙醇等有機溶劑。
 短裸甲藻毒素及其衍生物分子結構
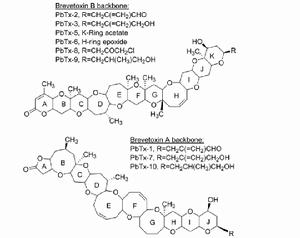
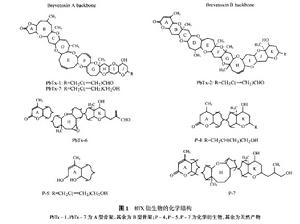
短裸甲藻毒素及其衍生物分子結構墨西哥灣貝類中的BTX代謝產物最初是通過對東方牡蠣(Crassostreavirginica)組織提取物和水華水體進行分離發現的。隨後的研究表明純毒素,游離的PbTx-2主要在東方牡蠣中代謝,而游離的PbTx-3則主要以其原有的形態蓄積於牡蠣中。鑑定的東方牡蠣中PbTx-2的主要代謝產物包括還原產物PbTx-3,半胱氨酸硫氧化物結合物BTX-B2(之前在紐西蘭貝類中發現的)和S-脫氧-BTX-B2。S-脫氧-BTX-B2可以穩定的氧化成BTX-B2,用作貝類的檢測和定量鑑定。
就穩定性與構型關係而言,A型毒素較B型穩定。在乾燥狀態下或在有機溶劑內,A型毒素的結構仍完整不變。該毒素具耐熱性,在300℃時仍保持穩定。pH值變化對穩定性影響大。當pH< 2或>10時可加速><型毒素的分解。在0.1mol/L NaOH水溶液中,毒素可用A環內醋的皂化而滅活。經臭氧分解,或在氯水(aqueous chloride)中亦使毒素活性受影響。
在東方牡蠣中,BTX代謝物的消除率和與其相關的極性和疏水性不是一致的。PbTx-1和PbTx-2的半胱氨酸結合物屬於極性最強的BTX代謝物,而同時也是持續最久的。Plakas等假設認為PbTx-1和PbTx-2與半胱氨酸蛋白的二分之一相結合,從而使半胱氨酸-BTX通過蛋白水解作用內收而緩慢釋放。游離的半胱氨酸或包含肽段的半胱氨酸(如谷胱甘肽)也可與PbTx-1和PbTx-2結合。貝類組織中半胱氨酸結合物最初快速消除的狀態表示此類結合物可能形成於游離的半胱氨酸或谷胱甘肽結合物的分解作用。分子結構
BTX毒素基本結構是由10到11個環狀結構構成的大環多醚類物質。根據結構的骨架不同可以分為A型(BTX-A,也即PbTx-A)和B型(BTX-B,也即PbTx-B),也可以稱之為1型和2型,這兩種基本結構分別於1981年和1987年被確定,其它組分則是從這兩類基本結構衍生而來。
 BTX毒素三維分子靜電勢圖
BTX毒素三維分子靜電勢圖貝類中的BTX代謝物A型和B型骨架結構的內酯環(A環)是通過水解形成的,這些包括PbTx-1和PbTx-2的半胱氨酸結合物形成的開環A環。A型BTX代謝產物的內酯環比B型更傾向於水解。發生在貝類體內的水解的範圍是未知的,PbTx-1和PbTx-2形成的A環開環化合物廣泛存在於短裸甲藻培養物和水華中。
 短裸甲藻毒素分子軌道模擬分布圖
短裸甲藻毒素分子軌道模擬分布圖將最佳化得到的7個化合物的空間結構疊加在一起,發現它們末端4個環可以很好地重合,從倒數第五個環開始,分子骨架出現彎曲,A型分子彎曲較小,近似直線型,而B型分子向上彎曲較大,這是由於B型H環構象發生了不同程度的變化。可見分子骨架彎曲程度同各自的生物活性強弱是很好對應的。因為A型比B型活性高,因此A型構象更適宜同受體結合。
A型與B型中段不飽和環與端部烯鍵的距離有明顯不同,在A型的PbTx-1中,E和F不飽和環與A環的空間距離為1. 46nm,與另一端R烯鍵的距離為1.48nm。在B型的PbTx-2中,H不飽和環與A環距離為1. 99nm,與R烯鍵相距0.97nm。由於A型活性強於B型,故推測A型中段不飽和環的位置更有利於同受體正電中心結合。A型的E,F環與兩端活性部位距離幾乎相等,正好位於骨架中心,由此推測與之結合的長約3n}n的受體活性區域,中間是正電中心,與兩端負電中心的距離大致相等。由於B型的H環偏離中心位置,在與受體正電中心結合時產生偏差,造成活性下降。
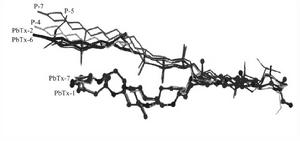 BTX毒素空間結構對比模擬示意圖
BTX毒素空間結構對比模擬示意圖毒性
對動物體毒性BTX-2(B型)是渦鞭毛藻產生最多的BTX毒素。當然,其他一些藻類,如古卡盾氏藻、海洋卡盾藻、針胞藻、赤潮異彎藻等也曾被報導可產生似BTX的生物毒素。BTX-2在貝類等生物體內的代謝產物主要是BTX-3、BTX-B1、BTX-B2、S-desoxy-BTX-B2、BTX-B3、BTX-B4和BTX-B5。因此消費者食用受污染的貝類和魚類導致的中毒主要是由BTX毒素的代謝產物引起的,而非BTX毒素直接作用的結果。
BTX主要蓄積在東方牡蠣(Crassostreavirginica)、文蛤(Mercenaria)、峨螺(Busycon contrarium)、海扇(Austrovenus stutchburyi)、綠殼貽貝(Pernacanaliculus)等貝類中。貝類可通過攝食短裸甲藻細胞或從水中直接吸收BTX,並使其快速蓄積。牡蠣中的短裸甲藻水平較好地反映了短裸甲藻水華的進展和強度。已證實BTX可在接觸了純的BTX和短裸甲藻培養物的貝類中快速蓄積。在捕食雙殼貝類的食肉峨螺中發現,貝類中的營養轉移也是間接的。
BTX可在一些貝類體內進行代謝。BTX代謝的第一例報導是1992~1993年在紐西蘭爆發的NSP。幾年以後,美國發現的大範圍的BTX代謝證實是由接觸了短裸甲藻水華的貝類產生的,此次水華發生於墨西哥灣。其後發現BTX的代謝在多種貝類中都具有特徵性。因為在短裸甲藻中B型BTX分布廣泛,所以最初從貝類中分離和鑑定出的BTX代謝物是B型BTX。
BTX-2和BTX-3的小鼠急性毒性試驗24 h半致死劑量分別為200mg/kg b.w.和170 mg/kg b.w.。小鼠腹腔注射BTX-B3 在劑量濃度在300mg/kg b. w.時不具有毒性,而BTX-B4和BTX-B5的最小致死劑量分別為100和300-500mg/kg b. w.。小鼠分別腹腔注射BTX-B2、BTX-3和S-desoxy-BTX-B2所產生的中毒症狀基本相似。致死劑量毒素導致的症狀主要包括:15min後不動,死亡前呼吸麻痹,眼球突出,快速彈動後腿;而亞致死劑量毒素則造成腹式呼吸速率先迅速上升後急劇下降,四肢完全癱瘓,但3-5h後運動能力恢復。在接下來的7d觀察期結束時未出現進一步病理異常。通過靜脈注射給藥,小鼠立即中毒死亡。
小鼠口服的半致死劑量只有BTX-2(6600 mg/kg b. w.)和BTX-3(520 mg/kg b. w.)的。口服給藥一般5h後才出現死亡,這與注射給藥可致急性死亡不同。口服毒性效力BTX-2比BTX-3要低一個數量級以上。毒性效力差異主要是吸收率的不同引起的,而不是因為BTX-2在經過肝臟時進行了第一次代謝。
人類接觸短裸甲藻毒素有三個途徑:在赤潮期間,沿海形成之氣霧中雜有此種毒素,人類通過呼吸道吸入後導致哮喘樣發作,類似毒覃鹼受體興奮之症狀;赤潮毒化海洋環境污染了海洋魚貝類,人類因攝食污染短裸甲藻毒素的海鮮品而導致“神經性貝中毒”。其中毒表現類似CTX中毒,主要有消化系統及神經系統症狀;皮膚接觸含短裸甲藻毒素的海水,導致皮膚及黏膜出現刺癢及水疤等表現。儘管尚無中毒死亡的報導,但此毒素的嚴重致病性已被臨床及病理學家所證實。由於此種毒素可導致呼吸衰竭或心室纖顫,故對人類的潛在致死性不容忽視。
發生NSP中毒的各地區對致毒貝類和魚類體內BTX毒素的含量數據中,以1MU相當於4μg,BTX-2計(貝類中污染的BTX毒素含量多以MUs/100g為單位),致毒貝類中BTX毒素的濃度從880至49000μgBTX-2/kg b.w.不等。Naar 等套用競爭性ELISA 法測定魚肉中的BTX毒素(以BTX-3為標準),濃度從580至6000μgBTX-3/kg b.w.。歐洲國家尚無關於BTX類毒素在貝類和魚類中的限量標準。美國規定小鼠生物法安全標準為20 MUs/100g(0. 8 mgBTX-2/kg b. w.)。紐西蘭和澳大利亞最高限量為20MUs/100g,未規定哪一類BTX類。
毒理
毒素體內循環一般來說,主要採用腹腔注射、靜脈注射、口服等方式研究BTX毒素在小鼠體內的毒代動力學。有報導的僅限於BTX-2和BTX-3。結果表明,小鼠腹腔注射BTX-2和BTX-3,1h後血水平達到最高值,BTX-2組比BTX-3組先達到正常血水平的3倍,BTX-2在24h後主要以共軛半胱氨酸結合物的形式從尿液排出; 而採用靜脈注射BTX-3,毒素在1 min內在血液循環中消失,24h後通過膽汁排泄進入糞便; 若採用口服的方式,BTX-3快速且廣泛分散到各個器官,其中肝臟內含量最高,最後主要伴隨尿液和糞便排出到體外,且兩種方式含量相差不大。
呼吸是BTX毒素引起神經性中毒的主要方式之一,因此通過向小鼠氣管內滴入3H標記的BTX-3,研究該種方式引起的毒代動力學。結果發現,氣管內80%毒素被迅速吸收,從肺進入血液並被所有組織器官吸收。大部分的BTX-3從肺、肝臟和腎臟代謝迅速排出體外,另外20%的毒素分散到其他器官保留了7d。小鼠組脂肪、心臟、腸、腎臟、肝臟和肌肉的消除半衰期為28h,而大腦和睪丸大概需要90h。大約90%的毒素在96 h內排出體外,其中11%從尿液、64%從糞便排出。
BTX毒素主要對呼吸和心肌功能有抑制作用,產生自發、反覆的劑量依賴性肌肉收縮,造成束顫,抽搐或跳躍,與劑量顯著相關的呼吸速率下降,中樞和外周神經的支氣管收縮。
若干研究結果表明,BTX毒素可致染色體體外斷裂。BTX-2可誘導中國倉鼠卵巢細胞染色體畸變。通過單細胞凝膠電泳發現用BTX-2、BTX-3和BTX-9 孵育人體淋巴細胞後DNA受損傷(鏈斷裂)。在BTX-2、BTX-3和BTX-6孵育人T淋巴細胞白血病細胞Jurkat E6-1後也發現了DNA損傷。Leighfield等報告說,通過吸入暴露,BTX-2誘導了大鼠肝細胞DNA損傷,表明BTX-2也可引發體內染色體斷裂。
BTX是較強的鈉通道激活毒素,可以與鈉通道受體靶部位VI結合,開啟興奮膜上的鈉通道,可以使細胞膜對鈉離子的通透性增強,活化電壓門控鈉通道,產生較強的細胞去極化作用,引起神經肌肉興奮的傳導發生改變,對鉀通道不起作用。因而,BTX具有胚胎毒性、發育毒性、免疫毒性、遺傳毒性和致癌作用等毒性效應。
BTX毒素的毒性大小取決於兩個因素:毒素和目標物的親和力以及靶細胞中誘導反應的效力。BTX毒素最主要的致毒方式是通過與細胞膜上的電壓門控鈉離子通道位點5結合造成的。這種結合激活了通道5,失控的鈉離子內流進入細胞,使神經元細胞和肌肉細胞的細胞膜去極化。在大鼠小腦顆粒神經元細胞原代培養過程中,受體位點5在接觸BTX毒素後被激活,細胞內Ca2+濃度增加,致使急性神經損傷和細胞死亡,其中受BTX-1刺激組Ca2+濃度為BTX-2或BTX-3組的兩倍。已證實BTX毒素會影響哺乳動物大腦皮質突觸和神經肌肉的生成並可能使細胞肥大。所有這些反應都與大量持續性的細胞膜去極化有關。因吸入氣霧性BTX毒素引起的呼吸困難,同樣是由於神經細胞膜上鈉離子傳輸通道的打開造成的。在大鼠腦細胞膜製備和HEK 細胞表達成骨骼肌或心臟過程中,BTX-B2和脫氧BTX-B2與鈉離子通道結合位點親和力比BTX-3的低8-16倍。而在神經母細胞中,它們的效力比BTX-3的分別低3倍和8倍。BTX毒素也可激活免疫細胞的鈉離子通道,誘導發生生化反應例如細胞增殖、基因轉錄、細胞因子的產生和凋亡。
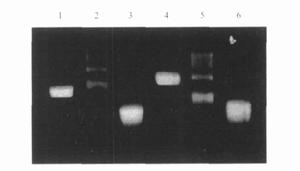 BTX毒素電泳圖
BTX毒素電泳圖檢測方法
BTX毒素的分析法主要有小鼠生物法(Mousebioassay,MBA)、細胞毒性實驗(Cytotoxicity assays)、受體結合試驗(Receptor binding assays)、放射免疫法(Radioimmunoassay,RIA)、酶聯免疫法(ELISA)和液相色譜串聯質譜法(LC-MS/MS)。其中,小鼠生物法是發展最早、套用最廣泛的分析方法,而高效液相色譜串聯質譜法則是定性、定量和靈敏度最好的方法。
BTX毒素所用的小鼠生物法是由美國公共衛生協會建立(APHA,1970)。標準方法使用乙醚從貝類中提取毒素,以MUs/100g貝肉為單位。1MU被定義為對體重為20g的小鼠腹腔注射粗提毒素使50%的小鼠在930min內死亡的用量,相當於4μgBTX-2。然而,一些研究指出乙醚並不能有效地提取BTX毒素(例如半胱氨酸結合物)。而且MBA方法的特異性、重現性和靈敏度都很差,不僅耗時太長,而且容易受到其他內源性化合物的影響,從而造成假陽性結果。
對貝類中的BTX毒素現已套用多個端點和多種檢測方式進行毒性實驗。細胞毒性試驗是基於BTX對鈉離子運輸通道的作用。多採用神經母細胞瘤,用藜蘆鹼通過打開鈉離子運輸通道從而促進鈉離子的轉運,同時用哇巴因(Na+/K+- ATP 酶抑制劑)阻斷鈉鉀離子泵活性。BTX毒素結合藜蘆鹼打開的鈉離子通道增加了離子流量。該細胞的生存力可以通過代謝溴化噻唑藍四氮唑成紫色結晶物質的量測定,方法對貝類中BTX-1的最低檢出限0.25mg/kg。但Dickey等人指出細胞毒性試驗在實驗室之間的重現性差,套用受到限制。
受體結合法是基於BTX毒素與鈉鹽傳輸通道受體的結合力差異。通常用於測定魚類和貝類中毒素含量的受體結合實驗,原理是放射性3H-BTX-3與天然BTX毒素與受體結合位點的競爭機制。從興奮性組織分離膜製備或通過全細胞製備用於試驗。半胱氨酸結合物(BTX-B2和S-desoxy-BTX-B2)與鈉離子通道受體的結合能力比BTX-3弱3-10倍。受體結合法的定量限是30μgBTX-3/kg牡蠣勻漿。
高效液相色譜串聯質譜法(LC-MS/MS)方法已被廣泛地用於貝類、魚類和藻類BTX毒素的定性和定量分析。Dickey等對實驗室間LC-MS/MS 法檢測數據的差異性進行了研究。實際上,所有LC-MS/MS方法可以很容易的檢測出BTX-3加標樣品,其含量水平比美國現行標準檢出限20MUs/100g或0.8 mgBTX-2/kg貝肉低出一個數量級。