相平衡
原理
相平衡原理主要是套用熱力學原理研究多相系統中有關相的變化方向與限度的規律,即研究溫度、壓力及組成等因素對相平衡狀態的影響。
研究方法
(1)解析法;
(2)圖解法。
研究意義
相平衡的研究無論在科學研究領域還是在工業生產方面都有著重要意義。例如,在冶金工業上根據冶煉過程中的相變情況,可以監測金屬的冶煉過程以及研究金屬的成分、結構與性能之間的關係;我國東部沿海和西部地區有豐富的天然鹽類資源,但這些海鹽、岩鹽和鹽湖中產的鹽都是混合物,只有用相平衡的原理及適當的溶解、重結晶等方法將其分離、提純,才能作為重要的化工原料;在有機合成及石化工業中,產品與副產品總是相互混雜的,用精餾、吸收、萃取等方法提取、純化,可以得到價值較高的產品,這些都要用到相平衡的知識。
相平衡條件的兩種形式
相平衡條件即為體系相平衡的判據,也稱為相平衡方程組。
判據一
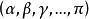 相平衡判據
相平衡判據n個相,N個組分達到多相平衡 ,等溫等壓且只做膨脹功時,滿足:
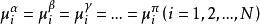 相平衡判據
相平衡判據結論:當不同相中化學勢不相等時,由熱力學第二定律,總是從化學位高的向化學位低的轉移直至平衡。
判據二
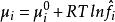 相平衡判據
相平衡判據因為,故也可以通過下面的式子判斷:
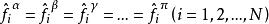 相平衡判據
相平衡判據結論:各相的溫度、壓力相等時,各組分中組分的分逸度相等。
判據的推導過程
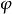 相平衡判據
相平衡判據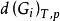 相平衡判據
相平衡判據設由N種組分和個相組成的系統,不發生化學反應,每個相都和其他相充分接觸進行相變。當體系發生一個微小的變化時,體系的吉布斯自由能也有一個微小的變化,,根據等溫、等壓吉布斯自由能判據,當自發過程平衡時有:
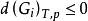 相平衡判據
相平衡判據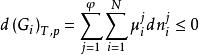 相平衡判據
相平衡判據利用拉格朗日方法有:
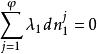 相平衡判據
相平衡判據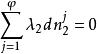 相平衡判據
相平衡判據 相平衡判據
相平衡判據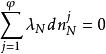 相平衡判據
相平衡判據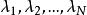 相平衡判據
相平衡判據式中為拉格朗日待定乘因子,將上述N個式子相加,得到自發過程平衡時有:
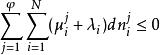 相平衡判據
相平衡判據達平衡時,每個dn都為零,故有:
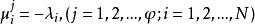 相平衡判據
相平衡判據即有:
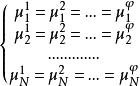 相平衡判據
相平衡判據上述式子即為相平衡的判據,該式表明:多組分、多相平衡體系,各相中同一組分的化學勢相等。
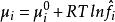 相平衡判據
相平衡判據另外,若根據,則可得到第二種判據形式。
