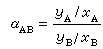定義式
 相對揮發度
相對揮發度α=(yA/yB)/(xA/xB),
式中,yA——氣相中易揮發組分的摩爾分數;yB——氣相中難揮發組分的摩爾分數;
xA——液相中易揮發組分的摩爾分數;xB——液相中難揮發組分的摩爾分數。
具體推導
液體混合物中兩組分的相平衡比的比值。組分 A對組分B的相對揮發度xAB可表示為: αAB=KA/KB (1)
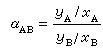 公式2
公式2式中KA和KB分別為組分A和B的相平衡比(見傳質分離過程)。同一混合液中,揮發性大的組分,一般相平衡比大,故易揮發組分對難揮發組分的相對揮發度大於1;反之則小於1。根據相平衡比的定義,式(1)
可改寫為: 公式2。式中yA和xA分別為組分A在汽相和液相中的摩爾分率;yB和xB分別為組分 B在汽相和液相中的摩爾分率。對於由組分A和B組成的雙組分混合液,yA=1-yB,xA=1-xB。據此可以導得: 公式3.(3)式表明:如果αAB大於1,則yA大於xA,即汽相中組分A得以增濃,A為易揮發組分。αAB比1大得愈多,則yA比xA也大得愈多;如αAB小於1,則yA小於xA,也即組分B在汽相得到增濃,B為易揮發組分。αA
B比1小得愈多,則B在汽相中的增濃愈顯著。當αAB等於1時,則yA等於xA,這表明用蒸餾方法不能分離此混合液。因此αAB與1偏離的程度是蒸餾操作分離液體混合物難易程度的標誌。
當混合物中液相為理想溶液且汽相為理想氣體時,套用拉烏爾定律和道爾頓分壓定律,可由式(2)導出: αAB =p2/p1
 相對揮發度
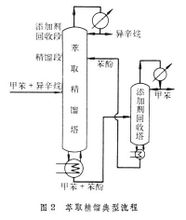
相對揮發度式中p1和p2分別為組分A和B的飽合蒸氣壓。此時相對揮發度為兩組分的飽和蒸氣壓(純組分揮發性的一種度量)之比。對於理想系統,相對揮發度與混合液的組成和溫度關係很小,工程上可視為常數。但強非理想系統的濃度對相對揮發度有較大的影響。此外,在工業上有時還在混合液中加入某種添加物來增大待分離組分間的相對揮發度,使難以用普通蒸餾分離的混合液變得易於進行分離。這就是萃取精餾、恆沸精餾和加鹽精餾等特殊精餾的基本依據。
 相對揮發度
相對揮發度