簡介
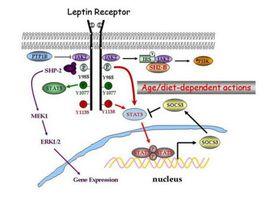
主要由白色脂肪組織產生。其前體由167個胺基酸殘基組成,N末端有21個胺基酸殘基信號肽,該前體的信號肽在血液中被切掉而成為146胺基酸,分子量為16KD,形成Leptin。Leptin具有廣泛的生物學效應,其中較重要的是作用於下丘腦的代謝調節中樞,發揮抑制食慾,減少能量攝取,增加能量消耗,抑制脂肪合成的作用。 研究表明編碼基因ob,缺失ob基因的大鼠,食慾旺盛,體重顯著增加,導致病態肥胖。它在身體的濃度使腦部知道現時身體上的脂肪數量,藉以控制食慾及新陳代謝的速率。
瘦素透過抑制體內神經肽Y neuropeptide Y (NPY)刺鼠肽基因相關蛋白agouti-related peptide (AgRP)的活躍程度,從而使體內另一種荷爾蒙黑色素細胞刺激激素alpha-melanocortin stimulating hormone (α-MSH)的活躍情度增強。
隨著2000年以來對瘦素探討的不斷深入,人們開始認識到瘦素不僅由脂肪組織分泌,其它組織如乳腺上皮細胞、胎盤、胃黏膜上皮細胞也中可檢測到,其受體不僅存在於丘腦、脂肪組織,還廣泛存在於全身各個組織。瘦素與機體系統的病理生理關係正逐步被人們了解。
原理
瘦素與肥胖
來自美國的科學家道格拉斯·高爾曼和傑弗理·弗理德曼在20世紀60至80年代,先後致力有關方面的研究,最後成功揭開這一科學謎底,二人亦因此成為東方諾貝爾之稱的邵逸夫獎生命科學與醫學獎得獎者,共獲得100萬美元獎金。
早在20世紀60年代,當時於美國緬因州傑克遜實驗室工作的高爾曼,在參與關於糖尿病和體重問題的老鼠實驗後,提出體重是與生物本身基因有密切關聯的科學猜想。他在受訪時憶述,隨後即開始了關於2種因基因突變而出現嚴重肥胖的老鼠的研究,結果成功發現,部分老鼠因無法產生某種抑制食慾的激素而致肥,另一部分則製造過量相關激素,但因身體缺乏接收有關激素訊息的受體,令其出現肥胖問題。
 瘦素食物
瘦素食物高爾曼設立的體重與激素及基因之間的假設,在80年代被於紐約洛克菲勒大學工作的弗理德曼重拾,他在長達10年的試驗中,終於定位了一種導致老鼠體重問題的基因,並將其命名為“瘦素”;他證實了某些人的確是在激素信號傳遞失衡的情況下產生肥胖,甚至因此胰島素失衡帶來糖尿病。這項“接力式”的合作科學成果為肥胖問題研究帶來革命性的改變,而弗理德曼亦將繼續嘗試從中尋找可完全治療肥胖的有效方式。道格拉斯·高爾曼發現,極少數人食量驚人,因為他們在體記憶體在著瘦素基因突變,產生的瘦素太少,這種病人在接受瘦素替代療法以後體重迅速下降,所以瘦素的發現讓人們對肥胖症的理解和認識有了飛躍,又向著擺脫肥胖邁進了一步。由於瘦素對於治療肥胖症有著非常好的療效,堪稱“減肥素”。預計在不久的將來以瘦素為主要成分的減肥藥,也很有可能會出現在我們的生活當中,從而在很大程度上改變普通人的生活。
發現背景
歷史
1994年Zhang等首次發表了利用定位克隆技術成功克隆了小鼠的ob基因和人類的同源序列並由基因預見ob蛋白的論文,開創了人類肥胖和能量代謝研究的新領域。Halaas等於1995年套用DNA重組技術,由大腸桿菌中合成ob基因的表達產物,將該蛋白命名為——瘦素(leptin)。
其主要功能是對能量平衡及體重進行調節。人血漿瘦素水平升高與人體脂肪重量成正比,瘦素及其受體基因突變可導致病態肥胖。在一項為期24周的研究中,每日皮下注射瘦素可使體重有不同程度的減輕。近年來研究發現,肥胖患者體內瘦素轉運至大腦的能力下降,從而造成肥胖個體的瘦素抵抗。因此,有研究者正致力於能通過血腦屏障的瘦素小分子類似物的研究,以開發有潛力的肥胖治療藥物。目前研究中的作用於瘦素受體的物質多為合成的短肽類物質,而小分子化合物還未見報導。
Wang等人的研究(2004)認為,瘦素,一種在脂肪組織中的胺基酸,它的作用在於存儲葡萄糖、降低體重、增加熱量、促進和刺激青春期的下丘腦—垂體—性腺軸發育成熟。他們發現:第二性徵的變化,如乳房萌芽(thelarche)和睪丸/陰莖增長呈正相關,為的是提高9到11歲的男女孩的血液凝集素水平和體重指數(BMI)測量值。此後,他們發現瘦素水平在女孩中持續增加,而在男孩中卻有所下降:在女孩中脂肪的增加是對雌激素減少生產做出的反應,而在男孩中減少是由於肌肉質量的構建。
肥胖已經成為危害人類健康的一大因素,科學家們進行了大量研究旨在找出擊退“大敵”的方法。英國媒體報導稱,英國白金漢大學克洛雷試驗中心主任邁克·考索恩教授提議將一種名為瘦素的激素加入嬰兒食品,尤其是嬰兒牛奶中,食用這種食品後嬰兒的一生就不會再有發胖的擔憂。
瘦素是一種由脂肪組織分泌的激素,人們之前普遍認為它進入血液循環後會參與糖、脂肪及能量代謝的調節,促使機體減少攝食,增加能量釋放,抑制脂肪細胞的合成,進而使體重減輕。科學家在去年的研究表明,在嬰兒時期攝取瘦素,可能可以固定大腦對食慾的反應,進而一生都不會過度飲食。
人們是在對老鼠的實驗中得到了這個發現的。據考索恩教授介紹,實際上在人類母乳中也含有這種物質,"含有添加物的牛奶不過是把原本就存在的東西的量增大了而已"。不過這一研究還處於最初階段,至少需要10年的時間才可能最終研製出可防止肥胖的嬰兒食品。
考索恩教授的計畫在科學界引起了極大爭議,人們最大的擔心就是它的安全性,比如劑量和副作用等問題。另外還有批評者認為這還涉及到倫理問題,他們認為肥胖是一種現代社會帶來的疾病,人們需要檢視並改變自己的生活方式來避免患病,而不僅僅是尋找一種可以快速解決問題的人工合成物。
最新調研顯示,肥胖已經稱為歐洲面臨的主要健康和社會負擔,兒童肥胖趨勢尤其令人擔憂。英國是歐洲兒童肥胖程度最高國家之一,超重兒童約占30%。
減肥效果
1999年11月,一位學者披露了他的研究結果,說是用瘦素治療肥胖症,可以加快體重下降速度,而使用大劑量瘦素則可使身體脂肪減少更多。在對123名肥胖者進行的4周試驗表明:使用0.01毫克瘦素者,體重下降了0.7公斤;使用0.10毫克者,下降了2.4公斤;使用0.30毫克者,則平均下降7公斤。
主要功能
瘦素的功能是多方面的,主要表現在對脂肪及體重的調控:
1、抑制食慾:瘦素可使人類進食明顯減少,體重和體脂含量下降。
2、增加能量消耗:瘦素可作用於中樞,增加交感神經活性,使大量貯存的能量轉變成熱能釋放。
3、對脂肪合成的影響:瘦素可直接抑制脂肪合成,促進其分解,也有人認為可促進脂肪細胞成熟。
4、對內分泌的影響:胰島素可促進瘦素的分泌,反過來瘦素對胰島素的合成、分泌發揮負反饋調節。
瘦素水平上升
 瘦素
瘦素造成瘦素抵抗,產生負性心肌肌力作用血漿中瘦素的水平通常與體重,尤其是身體內脂肪組織的變化呈正相關。臨床上肥胖症患者多出現不同程度的血液瘦素水平上升。由於瘦素的正常生理功能主要是通過瘦素受體介導的,肥胖症 中瘦素水平的上升直接造成了瘦素受體水平的反饋性下調或是受體後信號轉導受阻,這就是瘦素抵抗(LeptinResistance)。
瘦素抵抗的出現是直接由循環中瘦素水平上升而引起的。作一個非常恰當的比喻,瘦素抵抗在肥胖症中的地位類似於胰島素抵抗在2型糖尿病中的角色。生理水平的瘦素可引起血管舒張,對心肌功能無明顯影響,而病理水平的瘦素可促進大量氧化自由基的產生,進而產生明顯的負性心肌肌力作用。有證據表明,病理水平的瘦素引起的負性心肌肌力作用可能是通過內皮素受體(ET-1Receptor)及其下游的還原型輔酶Ⅱ(NAPDH)氧化酶的激活來實現的。NAPDH氧化酶的激活直接產生大量超氧陰離子。這些結果在瘦素過剩的db/db小鼠模型中已獲得證實。
瘦素水平下降
造成生理水平瘦素對心臟功能的調節缺失,導致心肌肥大、心功能低下與瘦素水平上調相反,瘦素水平的下降也可直接促使瘦素信號傳導的缺失,從而造成生理水平瘦素對心臟功能的調節缺失。筆者的實驗室對遺傳性瘦素缺乏的ob/ob肥胖鼠進行了深入的研究。結果表明,瘦素水平的低下導致小鼠明顯肥胖(其體重是野生型鼠的兩倍),心臟肥大,心肌收縮力下降,收縮/舒張速率減慢,舒張時間延長,心肌細胞鈣調節紊亂等多種心功能低下。有趣的是,補充瘦素能夠顯著改善由於瘦素缺乏造成的心肌肥大和心功能低下,同時對體重的增加有顯著的抑制作用。
進一步研究結果表明,瘦素水平的低下直接引起了胰島素敏感性的下降。筆者所在的實驗室在2007年對胰島素增敏劑鉻複合物進行了結構改變,得到了一種新的鉻胺基酸複合物(已取得美國專利),我們用該複合物對ob/ob瘦素缺乏的肥胖鼠進行了胰島素增敏治療。經過6個月的口服給藥[45μg/(kg/d)],ob/ob小鼠的心肌功能獲得明顯改善,心肌細胞內鈣調節紊亂得以糾正,而這些心肌功能指標的改善是與心肌胰島素敏感性的改善相吻合的。由此看來,無論是瘦素水平上升或缺失,均可導致瘦素對機體能量及脂肪代謝調節的紊亂,從而促成肥胖症以及最終2型糖尿病的發生。而高脂飲食或營養過剩均可導致瘦素水平急劇上升,以及由此引起的瘦素抵抗,使瘦素不能正常地完成對脂肪、能量代謝的促進及與此相關的食慾抑制作用。
瘦素在體內對人體的體重調節是雙向的,通常稱做體脂的自穩系統。可理解為:當人體能量攝入正平衡時,體脂增加,促使脂肪細胞瘦素分泌增多,瘦素作用於下丘腦,結合其受體,產生飽食反應,從而降低食慾,減少能量攝取,促進能量消耗;當人體體重降低時,脂肪組織瘦素分泌下降,作用於下丘腦的另一受體,產生飢餓反應,增加食慾,提高攝食量,降低能耗。 照這樣說,人體體重應該保持在正常範圍內,為何會出現肥胖者越來越多的現象呢?這就是瘦素抵抗問題。瘦素雖然分泌很多,但是發揮不了作用。大多數肥胖者血清瘦素水平比非肥胖者高;只有不到5%的肥胖者,其瘦素是缺乏的。 最為遺憾的是,肥胖者不但出現體內瘦素的抵抗反應,並且對外源性的瘦素也同樣存在抵抗性。因此,套用瘦素治療肥胖,目前還處於實驗階段。