生物地球化學循環
正文
生物所需要的化學元素在生物體與外界環境之間的轉運過程。“地球”一詞在這裡指生物體外的自然環境。生物體內的化學成分總是在不斷地新陳代謝,周轉速度很快,由攝入到排出,基本形成一個單向物流。在生物體重穩定不變的條件下,向外排出多少物質,必然要從環境再攝入等量的同類物質。雖然新攝入的物質一般不會是剛排出的,但如果把環境中的同類物質視為一個整體,這樣的一個物流也就可以視為一種循環。物流可能只是某個生物與環境之間的交換,也可能是由綠色植物開始,通過複雜的食物鏈再返回自然界。農業施肥和畜牧餵飼等是生物地球化學循環中的人工輔助環節。循環的物態 固態物質的移動性很小。地殼變動雖然可以使海底沉積的磷酸鹽升至地面,但這種幾率很低。生物可以搬運固態物質,例如海鳥捕食海魚後把糞排在海島,從而使一部分海中的磷質(可能是上升流由海底帶上來的)集中於地面。水速和風速達到一定程度時,也可攜帶固體物質。但這幾種運動的規模都不大。具有生學意義的主要是可溶性物質隨水流的運動。
生物需要的液態物質就是水及其中溶解的營養物。但水流只能由高而低單向流動,即從高海拔流向低海拔,最後匯于海洋。水分蒸發為氣態後才能隨氣流返回內陸,原來溶於水中的物質大部分不能隨同返回。氣態物質的活動性最大,特別是陸地生物生活於空氣中,攝取和排放氣態物質都很方便。自然界中的水、碳、氮、磷、硫等重要物質的循環,基本是以液、氣兩種物態運動的。以溶液方式運動的營養物(如磷),大量地以沉積物的形式貯存在土壤和岩石中,這類物質的循環也常稱為沉積型循環。
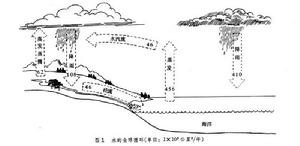
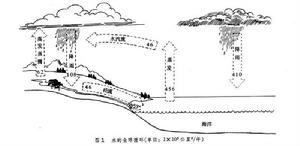
水循環 液態水是可溶性營養物的重要載體。由於陸地上江河歸海是單向流動,所以溶於水中的營養物從陸地流失後便難以返回。海水占地球總水量的97%;淡水只占3%,其中又有3/4為固態(冰)。所以陸地上可利用的淡水不足地球總水量的1%。淡水湖泊含水量占地球總水量的0.3%,土壤含水量也占0.3%,河流只占0.005%,還有少量水結合於生命活質中。陸地上的淡水分布很不均勻,有地區差異,也有季節年度差異。淡水分布不勻,再加上工業大量用水和水質污染等,這都使淡水資源問題日益突出。
水分的垂直移動主要表現為3種情況:一是太陽輻射的熱力作用使水面及土壤表層的水分蒸發;二是植物根系吸收的大量水分經葉面蒸騰;三是空中的水汽遇冷後又凝結降落。空中氣態水的周轉速度很快,一般持水量不大。水分的水平移動,在空中表現為氣態水隨氣流的移動,在地面表現為液態水自高向低的流動。所以,水循環的動力就是太陽輻射和重力作用。
在全球範圍內,海面的蒸發量大於降水量,一部分水降到大陸;陸地的降水量大於蒸發和蒸騰量,多餘的水流經地表和地下返回海洋。
 生物地球化學循環
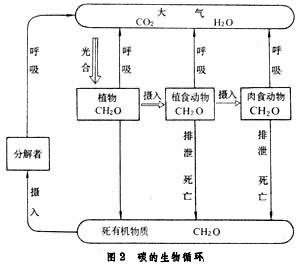
生物地球化學循環碳循環 碳是構成一切有機物的基本元素。綠色植物通過光合作用將吸收的太陽能固定於碳水化合物中,這些化合物再沿食物鏈傳遞並在各級生物體內氧化放能,從而帶動群落整體的生命活動。因此碳水化合物是生物圈中的主要能源物質。生態系統的能流過程即表現為碳水化合物的合成、傳遞與分解(圖2)。
 生物地球化學循環
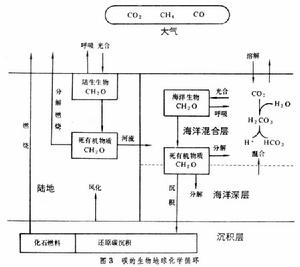
生物地球化學循環自然界有大量碳酸鹽沉積物,但其中的碳卻難以進入生物循環。植物吸收的碳完全來自氣態CO2。生物體通過呼吸作用將體內的CO2作為廢物排入空氣中。翻耕土地也使土壤中容納的一部分CO2釋放出來,腐殖質氧化產生的CO2更多。燃燒煤炭和石油等燃料也能產生CO2,特別是工業化以後,以這種方式產生的CO2量逐漸增大,甚至超過來自其他途徑的CO2量。大氣中的CO2一方面因植物的減少而降低了消耗,另一方面又因上述燃料使用量的增加而增多了補充,所以濃度有增加的趨勢。但海水中可以溶解大量CO2並以碳酸鹽的形式貯存起來,因此可以幫助調節大氣中CO2的濃度(圖3)。
 生物地球化學循環
生物地球化學循環氮循環 雖然大氣中富含氮元素(79%),植物卻不能直接利用,只有經固氮生物(主要是固氮菌類和藍藻)將其轉化為氨(NH3)後才能被植物吸收,並用於合成蛋白質和其他含氨有機質。在生物體內,氮存在於氨基中,呈-3價。在土壤富氧層中,氮主要以硝酸鹽(+5價)或亞硝酸鹽(+3價)形式存在。土壤中有兩類硝化細菌,一類將氨氧化為亞硝酸鹽,一類將亞硝酸鹽氧化為硝酸鹽,兩類都依靠氧化作用釋放的能量生存。除了與固氮菌共生的植物(主要為豆科)可能直接利用空氣中的氮轉化的氨外,一般植物都是吸收土壤中的硝酸鹽。植物吸收硝酸鹽的速度很快,葉和根中有相應的還原酶能將硝酸根逆行還原為NH3,但這需要供能。土壤中還有一類細菌為反硝化細菌,當土壤中缺氧而同時有充足的碳水化合物時,它們可以將硝酸鹽還原為氣態的氮(N2)或一氧化二氮(N2O)。由進化的角度來看,這一步驟極為重要。否則大量的氮將貯存在海洋或沉積物中。
在原始地球的大氣中可能含有氨,但大量生物合成耗盡這些氨後,固氮作用便成為必需。現已發現具有固氮作用的微生物是一些自由生活或共生的細菌以及某些藍藻。它們的營養方式有異養的,也有光能合成和化能合成的。總之,其固氮作用所需的能量要由外界提供。除生物外,空中的雷電以及高能射線也能固定少量氮氣。20世紀發展起來的氮肥工業,以越來越大的規模將空氣中的氮固定為氨和硝酸鹽。現在全球範圍的固氮速度可能已超過反硝化作用釋放氮的速度。另外,由於工業固氮是以能源消耗為代價的,所以應該珍視生物固氮這個環節,而某些農林業措施或環境污染會破壞正常的土壤微生物亞系統(圖4)。
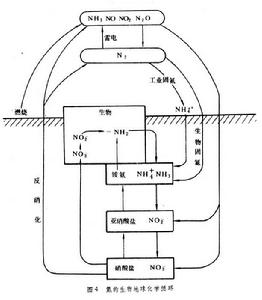 生物地球化學循環
生物地球化學循環磷循環 磷主要以磷酸鹽形式貯存於沉積物中,以磷酸鹽溶液形式被植物吸收。但土壤中的磷酸根在鹼性環境中易與鈣結合,酸性環境中易與鐵、鋁結合,都形成難以溶解的磷酸鹽,植物不能利用。而且磷酸鹽易被徑流攜帶而沉積于海底。磷質離開生物圈即不易返回,除非有地質變動或生物搬運。因此磷的全球循環是不完善的。磷與氮、硫不同,在生物體內和環境中都以磷酸根的形式存在,因此其不同價態的轉化都無需微生物參與,是比較簡單的生物地球化學循環。
磷是生命必需的元素,又是易於流失而不易返回的元素,因此很受重視。據觀察,某些含磷廢物排入水體後竟引致藻類暴發性生長,這說明自然界中可利用的磷質已相當缺乏。岩石風化逐漸釋放的磷質遠不敷人類的需要,而且磷質在地表的分布很不均勻。目前開採的磷肥主要來自地表的磷酸鹽沉積物,因此應該合理開採和節約使用。同時應注意保護植被,改造農林業操作方法,避免磷質流失(圖5)。
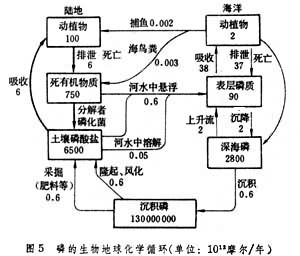 生物地球化學循環
生物地球化學循環硫循環 硫主要以硫酸鹽的形式貯存於沉積物中,以硫酸鹽溶液形式被植物吸收。但沉積的硫在土壤微生物的幫助下卻可轉化為氣態的硫化氫(啹S),再經大氣氧化為硫酸(H2SO4)復降於地面或海洋中。與氮相似的是,硫在生物體內以-2價形式存在,而在大氣環境中卻主要以硫酸鹽(+6價)形式存在。因此在植物體內也存在相應的還原酶系。在土壤富氧層和貧氧層中,分別存在氧化和還原兩種微生物系,可促進硫酸鹽與水之間的相互轉化(圖6)。
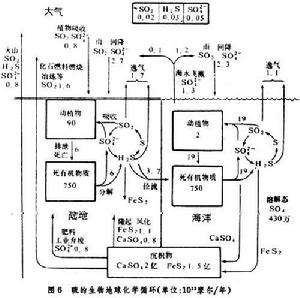 生物地球化學循環
生物地球化學循環其他元素和化合物的循環 除前述幾種重要元素和化合物外,被植物根系吸收乃至隨食物進入動物體內的化學物質還有許多,大致可分為生物必需的營養物質和非必需的化學物質兩類。前一類包括鈣、鉀、鈉、氯、鎂、鐵等元素和維生素等化合物,它們在生物體內的濃度常有一定限度,是由生物體本身調節的;後一類如汞、鉛等,逐漸受到重視,因為非必需物質達到一定濃度時可能造成機體功能紊亂,甚至破壞機體結構導致中毒。環境污染是造成這類中毒的主要原因。上述物質的循環常包括多生物環節。例如腸道微生物能製造動物體需要的某些B族維生素,它們又依靠腸道內的廢物為生,形成一種人體內循環。再如生物對自己所需的營養物質有一定的濃縮本領,能把分散於環境中的低濃度營養物質濃縮到體內。但很多非必需物質也常一同被濃縮,如果不能及時將其降解或排泄掉,便可能引起中毒。這類物質積累在生物體內並沿食物鏈傳遞其濃縮係數逐級增加,到頂級肉食動物體內便能達到極高的濃度。例如湖水中的DDT經水生植物、無脊椎動物和魚類,最後到達鳥類時其濃度竟比湖水中的高几十萬倍(圖7)。
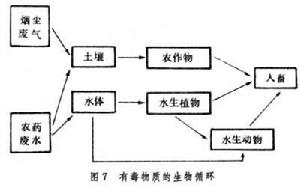 生物地球化學循環
生物地球化學循環營養物質收支 地球上的所有生態系統幾乎都不同程度地與外界進行物質交換,因此不存在完全的閉路循環。然而一個成熟的生態系統,物質流失很少,輸入與輸出大致平衡(圖8)。
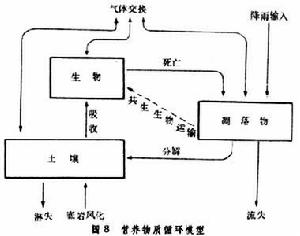 生物地球化學循環
生物地球化學循環圖8中的模型根據三個假設:①系統內物質總量取決於輸入和輸出速率的對比;②系統內各分室間的物質量取決於分室間的流通率;③總量和各分室量有保持穩定的傾向。模型表明,生物、凋落物和土壤三個分室構成單向循環,每個分室都可以與外界有氣體交換,營養物質的輸出主要表現為土壤和凋落物中營養物質的流失。有人提出,在成熟的熱帶雨林中,物質可能存在由凋落物分室直接返回生物分室的渠道,例如某些共生真菌可以直接消化凋落物中的有機質,並通過菌絲提供給根系,避免了淋溶流失。
結束語 千百年來,人類不斷擴大用人為的農業生態系統代替自然生態系統,用人為的物質循環渠道代替自然的物質循環渠道。例如在農田中,一年生作物的單種栽培代替了自然植被,消滅了大量肉食動物,只保留少數役用和肉用植食動物。人工灌溉系統減輕了缺水地區和缺水季節的供水問題,稻稈餵飼家畜和糞肥施田形成了局部循環,但不恰當的耕作方法卻造成水土流失。特別是工業化以後,大量生產礦質肥料和人造氮肥,極大地改變了自然界原有的物質平衡。而且,工業污染物侵入生物地化循環渠道,對人畜造成直接威脅。所以,人類應該保護自然界營養物質的正常循環,甚至通過人工輔助手段促進這些循環。同時,還應有效地防止有毒物質進入生物循環。生物圈中,一些物種排泄的廢物可能是另一些物種的營養物,從此形成生生不息的物質循環。這一事實也啟發人們在生產中探求化廢為利的途徑,這樣既能提高經濟效益,又可防止污染環境。
參考書目
E.Frieden,The Chemical Elements of Life,in:Scicntific American, Vcl. 227, July,1972.