自由體積理論
自由體積理論最初由Fox和Flory提出來的,主要工作是由Turnbull和Cohen完成。自由體積理論認為:液體或固體的體積由兩部分組成,一部分是被分子占據的體積,稱為已占體積;另一部分是未被占據的體積,稱為自由體積。後者以“空穴”的形式分散於整個物質之中,自由體積的存在為分子鏈通過轉動和位移調整構象提供可能性。當高聚物冷卻時,自由體積先逐漸減小,到達某一溫度時,自由體積達到最低值,維持不變。此時,高聚物進入玻璃態。因而高聚物的玻璃態可視為等自由狀態。
自由體積理論採用一個參量——自由體積描述玻璃化轉變過程中物性的變化,能夠很好地解釋玻璃化轉變附近的粘度和熱容隨溫度的變化關係。但是研究發現:淬火後高聚物,在Tg以下,自由體積隨著放置時間延長而不斷減小。這是自由體積理論的不足之處。
熱力學理論
玻璃化轉變的熱力學理論是Gibbs和DiMarzio在20世紀60年代末為解釋聚合物玻璃化轉變而提出的,簡稱為G-D理論。G-D理論認為:溫度降低時,構象熵隨著溫度降低而減少,當構象熵降低至零時,物質發生玻璃化轉變(構象熵隨溫度變化)。構象熵包括所有聚合物的構型、位置及取向。
聚集態下高聚物的構象熵是很難計算的,想計算出高聚物的二級相變溫度T2和玻璃化轉變溫度Tg是非常困難的。但是G-D理論成功地解釋了高聚物玻璃化轉變過程中的增塑劑效應、交聯度等問題。
動力學理論
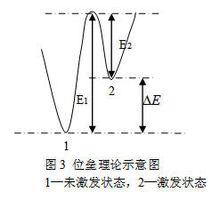
動力學理論一種類型是位壘理論。該理論認為:高分子鏈段構象重排時,涉及到主鏈上的單鍵的旋轉,鍵的旋轉存在著位壘。當溫度在Tg以上時,分子運動有足夠的能量去克服位壘,達到平衡。當溫度降低時,分子熱運動的能量不足以克服位壘,於是發生分子運動的凍結。位壘理論示意圖見圖3 。
 玻璃化轉變理論
玻璃化轉變理論由圖3可以知道,兩個能量狀態E1,E2存在能量差,正因為能量差促使高聚物玻璃化轉變。
玻璃化轉變現象具有明顯的動力學性質,位壘理論從理論驗證了這一點,而且很好地解釋玻璃化轉變中的弛豫現象。但是,位壘理論無法從分子結構的角度預算玻璃化轉變溫度。
熱力學理論很難說明玻璃化轉變時複雜的時間依賴性,而動力學理論難以從分子結構角度預算Tg。比較完善的玻璃化轉變理論應該同時考慮這兩方面。
