定義
系統由一個狀態到達另一個狀態的變化過程稱為熱力過程,簡稱過程。狀態改變意味著系統原平衡態被破壞。實際熱工設備中進行的過程,都是由於系統內部各處溫度、壓力或密度的不平衡而引起的,所以過程所經歷的中間狀態是不平衡的。
如果在熱力過程中系統所經歷的每一個狀態都無限地接近平衡態,這種過程稱為準平衡過程,又稱為準靜態過程,在狀態參數坐標圖上可以用連續的實線表示。而非平衡過程由於它所經歷的不平衡狀態沒有確定的狀態參數,因而不能表示在狀態參數坐標圖上。
圖像表示
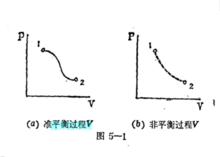 準平衡過程與非平衡過程的PV圖
準平衡過程與非平衡過程的PV圖如果用坐標軸代表某兩個狀態參量,則體系的任意平衡態可以用圖上的一個點來描寫,非平衡態卻不能如此描寫,因為非平衡態至少有一個參量是不存在確定值的。
準平衡過程可以在PV圖上用實線描述,非平衡過程則用虛線代表,它不能用PV圖描述。在準平衡過程中,體系的狀態參量不僅有明確的數值,而且與外界的相應參數(如壓強)數值相同。
準平衡過程中的功
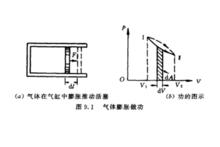 氣體膨脹做功
氣體膨脹做功 準平衡過程
準平衡過程計算準平衡過程中的功的典例。設有一氣缸,活塞的截面積為S。隨著氣體膨脹,活塞移動了dl後,氣體所做的元功為: ,式中dV為氣體容積的改變。設氣體從狀態Ⅰ變化到狀態Ⅱ,在圖中以實線Ⅰ和Ⅱ表示;功dA可以用畫有陰影的小面積來表示。從狀態Ⅰ變化到狀態Ⅱ,氣體總功基本等於上述小面積的總和,即曲線下的面積:
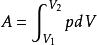 準平衡過程
準平衡過程。
當氣體膨脹,系統對外界做功時,A>0。當氣體被壓縮,外界對系統做功時,A<0。從圖中可知,系統沿虛線所示的過程比沿著實線的過程做的功大。所以,系統由一個狀態變化到另一個狀態時所做的功,不僅取決於它的始末狀態,而且和它經歷的過程有關。套用熱力學第一定律於有限的準平衡過程得:
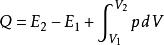 準平衡過程
準平衡過程 準平衡過程
準平衡過程上式中 是氣體初、末兩個狀態的內能。
套用熱力學第一定律於微小準平衡過程得:
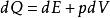 準平衡過程
準平衡過程 準平衡過程
準平衡過程我們知道,氣體的內能為氣體狀態的單值函式,氣體從一狀態變到另一狀態,不論其過程如何,其內能的改變 為一定值。由熱力學第一定律可以推知,氣體從一狀態變到另一狀態,既然內能的變化一定,做功必與過程有關,則氣體吸收或放出的熱量也與過程有關。
注意事項
實際過程
既要使系統的狀態發生變化,又要隨時無限接近於平衡態,只有使過程進行得無限緩慢才有可能實現。實際過程都是以有限的速度、在有限時間內進行的,都是不平衡過程。
弛豫時間
理論上,在沒有外界作用下,一個系統從非平衡態達到完全平衡態需要很長時間,但是從非平衡態趨近平衡態所需時間往往不很長,這段時間叫做弛豫時間。
實際上,在系統內外的不平衡勢(如壓力差、溫度差等)不是很大的情況下,弛豫時間非常短,可以將實際過程近似地看作準平衡過程。例如:在活塞式熱力機械中,活塞運動的速度一般在10 m/s以內,但氣體的內部壓力波的傳播速度等於聲速,通常每秒數百米,相對而言,活塞運動的速度很慢,這類情況就可按準平衡過程處理。
理論意義
準平衡過程是實際過程的極限情況,是一種科學抽象。但是,準平衡過程在熱學研究中卻具有十分重要的意義。實際上,熱力學的定量結論只嚴格地適用於準平衡過程。由於準平衡過程是實際過程的極限情況,所以熱力學結論一方面紿我們提供了實際過程的定量界限(如熱效率),另一方面也為實際過程給出間接的數量關係。當狀態量的變化與過程無關時,可用準平衡過程代替非平衡過程來計算兩個狀態之間的變化)。

