定義
化合物引入氰甲基的過程稱為氰甲基化,反應結果得到烷基乙腈。最簡單有效的方法就是利用相應的烷基氰化物進行相應的 C-H鍵活化進而發生偶聯反應 。也可以通過使三甲基矽基乙腈 (TMSCHCN) 脫掉三甲基矽基 (TMS) 後進行有關反應,也可以用 α-氰基乙酸 (HOOCCHCN)通過脫羧反應得到氰甲基活潑中間體,另外 4-異惡唑硼酸頻哪醇酯也可作為氰甲基的來源 。
乙腈的加成反應
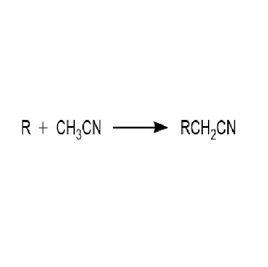
早在 1999 年,美國愛荷華州立大學 (Iowa State University) 的 Verkade 教授研究小組報導了首例鹼催化的 β-羥基氰化合物的合成。催化劑 A12 是一種非離子型強鹼。報導稱,體系中硫酸鎂作為路易斯酸,起到活化羰基的作用。反應在室溫下進行,產物 β-羥基氰的收率較高;且並未在反應中觀察到脫水產物的生成;遺憾的是,這一體系的高效不對稱合成還尚無報導 。
 氰甲基化
氰甲基化2003 年,日本東京大學 (The University of Tokyo) 的 Shibashaki 教授課題組報導了銅鹽催化的反應體系,如式 (1-42)。報導稱,叔丁醇亞銅鹽作為路易斯酸,通過和氰基配位作用活化了乙腈的 C-H 鍵,降低了乙腈的 pKa值;叔丁氧負離子起到脫質子的作用 。
 氰甲基化
氰甲基化此後,Shibashaki 等在 2004 年報導了陽離子釕絡合物作為催化劑的反應體系。在釕絡合物、DBU(一種二氮雜雙環的有機鹼)、六氟磷酸鈉的共催化下,使得芳基醛,脂肪醛和活潑亞胺和乙腈發生 Aldol 反應,以高收率獲得 β-羥基,β-氨基氰產物。報導稱,較大的同位素效應表明乙腈的去質子化是該反應的決速步;六氟磷酸鈉的加入抑制了 DBU 和釕的配位,這正是催化量鹼就能使反應完成的原因 。
 氰甲基化
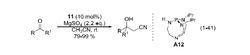
氰甲基化2005 年,美國布蘭迪斯大學 (Brandeis University) 的 Ozerov 等報導了一例以鎳螯合物為催化劑 (A13) 的反應體系。貧電子芳香醛和中性芳香醛底物的反應產率較高,而富電子芳香醛的反應效果不好。同位素效應表明決速步發生在C-C 鍵形成之前 。
 氰甲基化
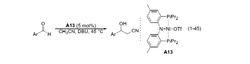
氰甲基化同樣是 2005 年,在之前的研究基礎之上 Shibashaki 課題組報導了首例乙腈對醛類化合物的不對稱加成反應。體系以叔丁醇亞銅為催化劑,以具有軸手性的雙膦配體 (A14) 進行不對稱誘導,產物收率較好,但對映選擇性中等 。
 氰甲基化
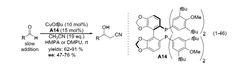
氰甲基化2008 年,日本名古屋大學 (Nagoya University) 的 Saito 教授研究小組報導了過渡金屬銠催化的 Aldol 型反應。體系以一價銠絡合物為催化劑,三環己基膦為配體;報導中未給出反應的機理。底物兼容性較好,芳香醛、雜芳香醛、α,β-不飽和醛、烷基醛等都能很好地和乙腈發生反應 。
 氰甲基化
氰甲基化乙腈的偶聯反應
1990 年,美國南衛理公會大學 (Southern Methodist University) 的 E. R. Biehl等報導了強鹼作用下的芳基溴化物和乙腈發生的交叉偶聯反應。但該反應經歷了苯炔中間體,產生了區域選擇性問題,加之會發生與溶劑,強鹼試劑的偶聯副反應,使得相應的氰烷基化產物收率普遍較低 。
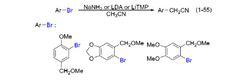 氰甲基化
氰甲基化2003 年,美國愛荷華州立大學 (Iowa State Universuty) 的 Verkade 小組報導了芳基氯代物和乙腈發生的偶聯反應,如式(1-56)。乙腈的用量為 1.2 當量,在催化量醋酸鈀、商業可得的配體 A19 及雙(三甲基矽基)氨基鈉 (NaHMDS) 的共同作用下,以 50%的產率獲得偶聯產物氰化苄;此外,還以 20%的產率獲得二苯基乙腈。若將乙腈的用量提高至 2 當量,氰化苄的收率為 70%,二苯基乙腈的產率為 10%。
此前 2002 年,當時還在耶魯大學 (Yale University) 開展研究工作的 Hartwig教授課題組報導過溴代苯和乙腈在鈀鹽催化作用下的反應。但在其發展的體系下,僅獲得二苯基乙腈而未發現單芳基化的氰化苄 。
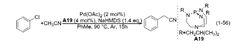 氰甲基化
氰甲基化實際上早在 2011 年,中國科學院上海有機化學研究所的劉國生研究員課題組就報導了和式 (1-52) 相同的反應。體系以醋酸鈀/2,2’-聯嘧啶 (A20) 為催化劑,在高碘試劑二特戊酸碘苯和氟化銀共同作用下,實現了兩步串聯反應。報導稱,苯基鄰位上的 C-H 鍵首先發生活化,和烯烴一端的碳發生偶聯反應;烯烴的另一端碳再和乙腈發生偶聯反應,如圖 (1-7)。即他們提出了和式 (1-52) 反應完全不一樣的反應路徑,故在此將其列入偶聯反應一類作出介紹。
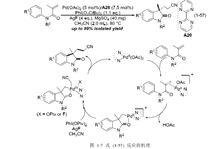 氰甲基化
氰甲基化上述反應中,當底物 R 基團為乙醯基或對甲苯磺醯基等吸電子基團時,反應不進行;若底物羰基 α 位置上的 sp 碳上沒有取代基,反應也不能進行;另外,同位素效應表明乙腈的 C-H 鍵活化是整個反應的決速步 。