概述
氫氧化二氨合銀的實質其實是 氫氧化銀,Ag(NH3)2OH實際上就是AgOH·2NH3,氫氧化二氨合銀溶液中存在以下以下組分:Ag(NH3)2+離子、NH3分子、NH3·H2O分子、NH4+離子、OH-離子和極少量的H+和Ag+離子。
名稱:氫氧化二氨合銀,銀氨。其水溶液又稱多倫溶液
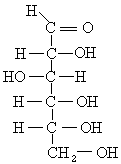 葡萄糖結構圖
葡萄糖結構圖或銀氨溶液
分子式:Ag(NH3)2OH
組成離子:Ag(NH3)2+(銀氨絡離子,又稱二氨合銀離子)、OH-
性質:氫氧化二氨合銀是一種 絡合物,有弱 氧化性。為強鹼,具有 腐蝕性,具有鹼的通性,溶解於水及乙醇,可電離。
純淨的氫氧化二氨合銀是白色晶體,極不穩定,容易分解為AgOH和NH3,AgOH又會分解為Ag2O和水,實驗室常見的是氫氧化二氨合銀的氨水溶液,一般用 氧化銀溶於氨水製得,具有強鹼性和強腐蝕性,因此被稱為“苛性銀”
二氨合銀和葡萄糖(C6H12O6)中的 醛基發生 銀鏡反應,在這個反應里, 硝酸銀與 氨水生成的銀氨溶液中含有氫氧化二氨合銀,這是一種弱氧化劑。銀被還原了出來。 葡萄糖結構圖如下。
製取
1.配製方法是:將AgNO3溶液與適量NaOH溶液混合,然後滴加稀氨水至沉澱剛好溶解。
(其反應具體過程與下文類似)
總方程式亦為2Ag++4NH3==2Ag(NH3)2+
2.教材中銀氨溶液配製過程中:向溶液里逐滴滴加氨水首先析出AgOH:
Ag++NH3·H2O==AgOH+NH4+
常溫下AgOH極不穩定,分解為Ag2O暗棕色沉澱
2AgOH==Ag2O+H2O
繼續滴加氨水,沉澱溶解:
Ag2O+4NH3+H2O=2Ag(NH3)2++2OH-
同時,生成的OH-與前面反應生成的NH4+反應:
OH-+NH4+==NH3·H2O
因此,向AgNO3溶液里加入稀氨水至沉澱溶解的總離子方程式為:
2Ag++4NH3==2Ag(NH3)2+
此時溶液中只含NO3-和Ag(NH3)2+,即得到Ag(NH3)2NO3,不是氫氧化二氨合銀
用途
可用來檢驗有機物中含有的醛基,如:乙醛、葡萄糖等。這種反應又叫 銀鏡反應。
氫氧化二氨合銀可將醛基氧化成羧基,方程式為:
RCHO+2Ag(NH3)2OH=Δ=RCOONH4+2Ag↓+3NH3+H2O
(此反應只用到Ag(NH3)2+,但使用Ag(NH3)2OH效果最佳)
生成的銀均勻附在內壁而形成銀鏡,所以叫銀鏡反應。
其他反應
氫氧化二氨合銀久置會生成Ag3N,方程式為:
3Ag(NH3)2OH+2H2O==Ag3N↓+5NH3·H2O
二氨合銀離子會微弱電離,放出銀離子:
Ag(NH3)2+==Ag++2NH3
因此可以和氯離子反應生成氯化銀沉澱:
Ag(NH3)2OH+Cl-==AgCl↓+2NH3+OH-

