簡介
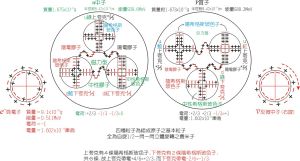
按照量子力學,原子內的電子可處於各種可能的定態,電子的運動狀態由n、l、ml、ms4個量子數描述。這4個量子數的取值規則是主量子數取正整數1、2、3、4、5…;對於每個n,角量子數l可取0、1、2、…n-1,共n個值;對於每個l,磁量子數m可取-l、-l+1、…、l,共2l+1個值,自鏇磁量子數ms取,或-。具有相同主量子數n的電子構成一個殼層,相同n按不同l又分為若干個支殼層,對應於l=0、1、2、…的支殼層分別用s、p、d、t表示。原子核外電子的排布遵從兩條規律:①泡利不相容原理。原子內不可能有兩個或兩個以上的電子具有完全相同的四個量子數。由此可確定原子內每個支殼層可容納的電子數為2l+1個,每個殼層可容納的電子數為2n2個,對於第1、2、3、4等殼層可容納的電子數分別為2、8、18、32、50。②能量最低原理。電子儘可能先填充能量較低的狀態,各狀態能量高低的順序可由經驗規律 n+0.7l值的大小加以判斷。由此可以確定隨著原子序數增大,核外電子填充支殼層的順序是:
排列
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f…電子的殼層排布與元素周期表一致,很好地說明元素的物理、化學性質周期性根源是原子內電子的殼層排布