基本方法
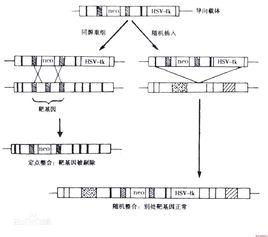
構建一種特殊的載體,該載體含有一段與靶基因同源的序列,在這段序列的某一外顯子中插入Ncor基因作為正選擇標記;在同循序列之外的3’末端,或3’,5’兩個末端接上單純皰疹病毒的胸腺嘧啶激酶(HSV-tk)基因的序列作為負篩選標記。經酶切後使其線性化,然後用電脈衝轉染法導入細胞中,繼續體外培養,並以藥物G -418和GANC作雙重篩選。如果所導入的重組 DNA與受體細胞基因組DNA之間發生非同源重組,則外源基因通常是從頭至尾均整合入受體細胞基因組中,故其基因組中含有外源的基因(Neor, HSV-tk),此時的Neor和HSV-tk基因同時表達,其中Neor的基因產物使細胞具有G-418抗性,而HSV-tk基因的產物則將GANC磷酸化產生對細胞有毒性的物質,使細胞死亡。若為同源重組,外源目的基因及Neor基因會整合到受體細胞基因組同源序列的座位上,而位於同源序列外端的 HSV-tk基因則在重組後丟失,因而此時僅有 Neor表達,受體細胞同時具有G-418及GANC雙重抗性而在選擇培養基中存活下來。Mansour和 Capecchi採用此方法,已完成ES細胞 Hprt,int- 2,hox1.2,hox1.3等基因的定點突變。
基因敲除
將細胞基因組中某基因去除或使基因失去活性的方法。常用同源重組的方法敲除目的基因,觀察生物或細胞的表型變化,是研究基因功能的重要手段。
條件性基因敲除
條件性基因打靶(conditional gene targeting),可定義為將某個基因的修飾限制於小鼠某些特定類型的細胞或發育的某一特定階段的一種特殊的基因打靶方法。以Cre-LoxP系統與基因打靶技術相結合的基因打靶技術。它實際上是在常規的基因打靶的基礎上,利用Cre重組酶介導的位點特異性重組技術,在對小鼠基因修飾的時空範圍上設定一個可調控的“按鈕”,從而使對小鼠基因組的修飾的範圍和時間處於一種可控狀態。
條件性基因打靶特點
①過條件性基因敲除,研究完全敲除具有致死效應的基因的功能以及基因在特定的組織細胞或個體發育特定階段的功能。 ②通過條件性基因激活,實現轉基因的可控制性表達。 ③通過Cre切除條件性基因修復(Cre excision-conditional gene repair),進行基因的可修復性敲除,以研究一個基因的多種功能。
誘導性基因打靶
它主要由Cre-LoxP及誘導系統組成。Cre-loxP系統由重組酶Cre和該酶的特定作用位點LoxP組成,其中的重組酶Cre可誘導LoxP所在的DNA發生缺失、插入、重複、倒位和易位等多種形式的基因突變或染色體畸變。誘導性基因打靶就是以該系統為基礎、利用控制Cre表達的啟動子的活性或所表達的Cre酶活性具有可誘導的特點,通過對誘導劑給予時間的控制、或利用Cre基因定位表達系統中載體的宿主細胞特異性和將該表達系統轉移到動物體內的過程在時間上的可控性、從而在LoxP動物的一定發育階段和一定組織細胞中實現對特定基因進行遺傳修飾之目的的基因打靶技術。
根據所用誘導劑的種類,誘導性基因打靶可分為 四環素誘導型、干擾素誘導型(二者所用誘導劑為控制Cre基因表達的啟動子活性的活化物)和激素誘導型(所用誘導劑為Cre酶活性的激活物)等幾種類型。而對由病毒或配體/DNA等載體介導的Cre定位表達系統來說,如果其Cre基因的表達或其目的產物Cre酶活性並不需要誘導劑的存在,那么嚴格說來它並不屬於誘導性基因打靶的範疇。反之,則不失為一種不錯的誘導性基因打靶策略,並且它因為不用建立Cre的表達或Cre的酶活性具有可誘導特性的轉基因動物而可使成本降低。
總之,以Cre-LoxP系統介導的位點特異性重組為基礎的誘導性基因打靶術的確有其 優勢: ①誘導基因突變的時間可人為控制; ②可避免因基因突變而致死胎的問題; ③在2個LoxP位點之間的重組率較高; ④如用病毒或配體/DNA複合物等基因轉移系統來介導Cre的表達,則可省去建立攜帶Cre的轉基因動物的過程。 如果在Cre-ERT和Ad-Cre表達系統中採用組織細胞特異的啟動子來控制Cre的表達,其誘導的基因重組的組織細胞特異性還可進一步提高。
基因診斷
基因診斷又稱DNA診斷或分子診斷,通過分子生物學和分子遺傳學的技術,直接檢測出分子結構水平和表達水平是否異常,從而對疾病做出判斷。
原理:
核酸分子雜交是基因診斷的最基本的方法之一。 基因診斷技術它的基本原理是:互補的DNA單鏈能夠在一定條件下結合成雙鏈,即能夠進行雜交。這種結合是特異的,即嚴格按照鹼基互補的原則進行,它不僅能在DNA和DNA之間進行,也能在DNA和RNA之間進行。因此,當用一段已知基因的核酸序列作出探針,與變性後的單鏈基因組DNA接觸時,如果兩者的鹼基完全配對,它們即互補地結合成雙鏈,從而表明被測基因組DNA中含有已知的基因序列。由此可見,進行基因檢測有兩個必要條件,一是必需的特異的DNA探針;二是必需的基因組DNA。當兩者都變性呈單鏈狀態時,就能進行分子雜交。 一、基因探針基因探針(probe)就是一段與目的基因或DNA互補的特異核苷酸序列,它可以包括整個基因,也可以僅僅是/基因的一部分;可以是DNA本身,也可以是由之轉錄而來的RNA。
常用技術
當細胞的基因組DNA用特定的內切酶如Eco RⅠ切割時, 基因診斷凡有GAATTC的地方都被切開,得到許多長度一定但互不相等的片段,需要分析、分離的基因或DNA片段就在其中某一特定的的片段上。 然而許多長短不同的DNA片段混合在一起是很難分析的。因此首先必需將它們按大小(長短)分離開來,這可藉助凝膠電泳來完成。在電泳時,分子量愈小的片段的遷移愈快,愈大的片段愈慢。因此,在電泳結束時可以獲得一個由大到小連續的帶譜(smear),而由許多細胞基因組得來的某一特定片段,因其長度相同將處於同一位置,有利於檢出。但凝膠易碎且操作不便。英國科學家Southern首創印跡法克服了上述困難。
Southern印跡法
Southernblot的基本原理是:硝酸纖維膜或尼龍濾膜對單鏈DNA的吸附能力很強,當電泳後凝膠經過DNA變性處理,覆以上述濾膜,再於其上方壓上多層乾燥的吸水紙,藉助它對深鹽溶液的上吸作用,凝膠上的單鏈DNA將轉移到濾膜上。轉移是原位的,即DNA片段的位置保持不變。轉移結束後,經過80℃烘烤的DNA,將原位地固定於膜上。 當含有特定基因片段已原位轉移到膜上後,即可與同位素標記了的探針進行雜交,並將雜交的信號顯示出來。雜交通常在塑膠袋中進行,袋內放置上述雜交濾膜,加入含有變性後探針的雜交溶液後,在一定溫度下讓單鏈探針DNA與固定於膜上的單鏈基因DNA分子按鹼基到互補原理充分結合。結合是特異的,例如只有β珠蛋白基因DNA才能結合上β珠蛋白的探針。雜交後,洗去膜上的未組合的探針,將Ⅹ線膠片覆於膜上,在暗盒中日光進行放射自顯影。結合了同位素標記探針的DNA片段所在部位將顯示黑色的雜交帶,基因的缺失或突變則可能導致帶的缺失或位置改變。
分子雜交是基因探測的基礎,除了用印跡雜交外,還有斑點雜交法。即將DNA樣品變性後直接點在硝酸纖維濾膜上,再與探針雜交,或者將細胞或病毒點在膜上,菌落或菌斑原位地吸附在膜上,經過變性處理,再進行雜交。斑點雜交多用於病原體基因,如微生物的基因,但也可用於檢查人類基因組中的DNA序列。
聚合酶鏈反應
近年來,基因分析和基因工程技術有了革命性的突破,這主要歸功於聚合酶鏈反應(polymerase chain reaction,PCR)的發展和套用。套用PCR技術可以使特定的基因或DNA片段在短短的2-3小時內體外擴增數十萬至百萬倍。擴增的片段可以直接通過電泳觀察,也可用於進一步的分析。這樣,少量的單拷貝基因不需通過同位素提高其敏感性來觀察,而通過擴增至百萬倍後直接觀察到,而且原先需要一、二周才能作出的診斷可以縮短至數小時。 首先應按照欲檢測的DNA的5’和3’端的鹼基順序各合成一段長約17-20餘個鹼基的寡核苷酸作為引物(primer),其次是將待檢測的DNA變性後,加入四種單核苷酸(dNTP)、引物和耐熱聚合酶。在較低的溫度,引物將與待擴增的DNA鏈復性結合,然後的聚合酶的作用下,利用溶液中的核苷酸原料,不斷延伸合成新互補鏈,這樣,一條DNA雙鏈就變成了兩條雙鏈。若繼續按照變性(92-95℃)→復性(40-60℃)→引物延伸(65-72℃)的順序循環20至40個周期,就可以得到大量的DNA片段。理論上循環20周期可使DNA擴增2n,即100餘萬倍。PCR反應特異性強,靈敏度高,極微量的DNA即可作為擴增的模板得到大量的擴增片段。毛髮、血痕,甚至單個細胞的DNA即可供PCR擴增之用。因此它用於病原體DNA的檢查、腫瘤殘留細胞的檢出、罪犯或個體遺傳物質的鑑定以及遺傳病的基因診斷等。
已可對一系列的遺傳病進行PCR診斷。如果疾病是由基因缺失引起的(如α地貧),則在缺失兩端設計一對引物進行擴增,就不會得到擴增產物或只能得到縮短了的擴增產物。如果疾病是由點突變引起的,而突變的位置和性質已知,則在設計引物時使之包括突變部位,由於突變後的鹼基不配對,結果無擴增片段;或者在引物設計時於其3’端設計一個錯誤的核苷酸,使之與突變了的核苷酸配對,其結果是正常引物不能擴增,而用錯誤的引物能擴增,從而可對突變的存在作出判斷。 PCR技術目前有許多新的發展,用途日益擴大。例如,可用RNA為模板經過逆轉錄再行擴增的RT-PCR;改變兩引物濃度,使其相差100倍,結果得到大量單鏈產物,稱為不對稱PCR,其單鏈產物可用於序列分析;在一個反應中加入多對引物同時檢測多個部位的多重PCR等等。
擴增片段長度
多態性小衛星DNA和微衛星DNA的長度多態性可以通過PCR擴增後電泳來檢出,並用於致病基因的連鎖分析,這種診斷方法稱為擴增片段長度多態性(amplified fragment length polymorphism,Amp-FLP)連鎖分析法。PCR擴增後,產物即等位片段之間的差別有時只有幾個核苷酸,故需用聚丙烯醯胺凝膠電泳分離鑑定。此法多用於突變性質不明的連鎖分析。
等位基因的特異
寡核苷酸探針診斷法當基因的突變部位和性質已完全明了時,可以合成等基因特異的寡核苷酸探針(allele-specific oligonucleotide,ASO)用同位素或非同位素標記進行診斷。探針通常為長20bp左右的核苷酸。用於探測點突變時一般需要合成兩種探針,一種與正常基因序列完全一致,能與之穩定地雜交,但不能與突變基因序列雜交;另一種與突變基因序列一致,能與突變基因序列穩定雜交,但不能與正常基因序列穩定雜交,這樣,就可以把只有一個鹼基發生了突變的基因區別開來。 PCR可結合ASO,即PCR-ASO技術,即先將含有突變點的基因有關片段進行體外擴增,然後再與ASO探針作點雜交,這樣大大簡化了方法,節約了時間,而且只要極少量的基因組DNA就可進行。
單鏈構象多態性診斷法
單鏈構象多態性(signlestrand conformation polymorphism,SSCP)是指單鏈DNA由於鹼基序列的不同可引起構象差異,這種差異將造成相同或相近長度的單鏈DNA電泳遷移率不同,從而可用於DNA中單個鹼基的替代、微小的缺失或手稿的檢測。用SSCP法檢查基因突變時,通常在疑有突變的DNA片段附近設計一對引物進行PCR擴增,然後將擴增物用甲醯胺等變性,並在聚丙烯醯胺凝膠中電泳,突變所引起的DNA構象差異將表現為電泳帶位置的差異,從而可據之作出診斷。 PCR-SSCP法具有能快速、靈敏地檢測有無點突變或多態性的優點,但如欲闡明突變的鹼基性質,則需作序列分析。