理論基礎
標準摩爾反應焓變是指參加反應的各物質都處於標準態時的反應焓變,記為△H ,單位為kJ/mol。
計算標準摩爾反應焓變的理論基礎是Hess定律,即在恆容或恆壓條件下,一個化學反應不論是一步完成或分幾步完成,其反應熱(即摩爾反應焓變)完全相同。
Hess定律的實質是指出了反應只取決於物質的初、終狀態,而與經歷的具體途徑無關。其重要意義在於能使熱化學方程式像代數方程式一樣進行加、減運算,從而可以套用已知化學反應的熱效應,間接算得未知化學反應的熱效應,解決那些難以測量或根本不能測量的反應熱效應問題。套用時要注意:將已知的熱化學方程式進行線性組合的結果必須與欲求的未知化學反應的狀態完全相同,包括溫度、壓力及各物質的相態,並且這些化學反應都是在等溫、等壓或等溫、等容條件下進行的,都不做其他功能。
焓的絕對值是無法確定的,但可以採用相對焓值。焓是狀態函式,狀態函式的最主要特點是其變化值只取決於系統的始態和終態,而與系統變化的途徑無關。因此,以Hess定律為理論基礎,可以求得反應的摩爾焓變。
相關定義
標準摩爾生成焓
在溫度為T的標準態下,由穩定相態的單質生成1mol的β相態的化合物B(β),該生成反應的焓變即為該化合物B(β)在溫度T時的標準摩爾生成焓,記為△H (β,T),單位為kJ/mol。
生成焓僅是個相對值,相對於穩定單質的焓值等於零。
標準摩爾燃燒焓
在溫度為T的標準態下,1mol的β相態的物質B(β)與氧進行完全氧化反應時,該生成反應的焓變即為該物質B(β)在溫度T時的標準摩爾燃燒焓,記為△H (β,T),單位為kJ/mol。
“完全氧化”是指在沒有催化劑作用下的自然燃燒。規定的指定產物不同,焓變值也不同。
標準摩爾反應焓變的計算方法
利用熱化學方程式的組合計算
已知一些分反應的標準摩爾反應焓變,利用熱方程式的組合可以求得總反應的標準摩爾反應焓變。
例如計算碳和氧氣反應生成CO的反應焓變。碳和氧可以一步直接生成CO,也可以先生成CO,再使CO與氧氣繼續反應生成CO,根據Hess定律,這二種途徑的反應熱效應是完全相同的。
△H =△H +△ H;
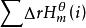 標準反應焓變化
標準反應焓變化即△H = 。
需要注意的是:在方程式的組合過程中,把相同物質消去時,不僅物質種類必須相同,而且狀態也要相同,否則不能相消。
利用標準摩爾生成焓計算
對任一化學反應,利用各種反應物和生成物的標準摩爾生成焓變的數據,就可以求得該反應的標準摩爾反應焓變△H 。物質的標準摩爾生成焓變的數值可從各種化學、化工手冊或熱力學數據手冊中查到。
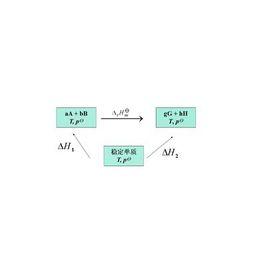
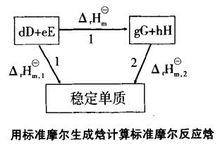
可以通過設定路徑來計算反應的摩爾焓變。對任何一個化學反應來說,其反應物和生成物的原子種類和個數是相同的,因此可以用同樣的穩定單質來生成反應物和生成物。例如對反應dD+eE=gG+hH,設定路徑如圖。
 標準反應焓變化
標準反應焓變化根據Hess定律,若把參加反應的各穩定單質定為始態,把反應的生成物定為終態,則途徑1和途徑2的反應焓變應相等,所以:△H =△H △H ;
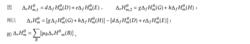 標準反應焓變化
標準反應焓變化即一定溫度下,化學反應的標準摩爾反應焓變,等於同溫度下產物的標準摩爾生成焓之和減去反應物的標準摩爾生成焓之和。
利用標準摩爾燃燒焓計算
有機物難於直接從單質合成,其標準摩爾生成焓數據難以得到,但有機物容易燃燒,可利用燃燒焓的數據來求算某些反應的焓變。對於一個化學反應來說,其反應物和生成物的原子種類和數目相同,它們完全燃燒的產物也勢必相同。可設定路徑如圖所示。
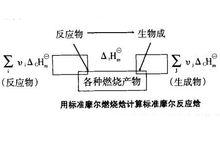 標準反應焓變化
標準反應焓變化根據Hess定律,若把反應物作為始態,燃燒產物作為終態,則:
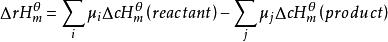 標準反應焓變化
標準反應焓變化。
即化學反應的標準摩爾焓變等於反應物的標準摩爾燃燒焓之和減去產物的標準摩爾燃燒焓之和。
利用水合離子的標準摩爾生成焓計算
 標準反應焓變化
標準反應焓變化 標準反應焓變化
標準反應焓變化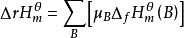 標準反應焓變化
標準反應焓變化對於水溶液中有離子參加的反應,如果知道水合離子的標準摩爾生成焓,就可求得該反應的標準摩爾反應焓變 。由於離子都是成對存在的,無法測定單一離子的生成焓,為此必須規定一個相對標準,在此基礎上求得其他水合離子生成焓的相對值。因此人為地規定氫離子的標準摩爾生成焓為零,即 ,由此可以獲得其他水合離子生成焓的相對值。可按下式計算反應焓變:。
利用鍵能估算
對於那些缺少標準摩爾生成焓數據的反應,可由鍵能來近似計算反應的焓變。鍵能計算反應焓變只適用於氣相反應,有固體或液體參加的反應,不能直接用鍵能來計算其反應焓變,而應該將固體或液體先變成氣體,然後才能進行計算。
由鍵能計算所得的數值準確度並不高,這是由鍵能數據本身的局限性所決定的。對雙原子分子而言,鍵能就是鍵的解離能。對多原子分子,鍵能實際上是平均鍵能。用鍵能可估算化合物的標準摩爾生成焓變。可以假設這樣一個過程,即將穩定單分子的鍵斷開成為氣態原子,然後再將氣態原子組合成這個化合物的各種鍵。
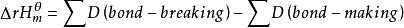 標準反應焓變化
標準反應焓變化。
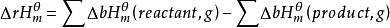 標準反應焓變化
標準反應焓變化即氣相反應的焓變等於破壞鍵所需要的能量之和減去形成鍵所放出的能量之和。或者氣相反應的焓變等於反應物的鍵能之和減去產物的鍵能之和:。