簡介
效應生物標誌是指機體中可測出的生理、生化、行為或其他改變的指標,反映與不同靶劑量的外源化學物或其代謝物有關聯的對健康有害效應的信息。
效應生物學標誌包括早期效應生物學標誌、結構和或功能改變效應生物學標誌及疾病效應生物學標誌,早期生物學標誌主要反映化學物與機體作用後分子水平上產生的改變。結構和功能改變的生物學效應生物學標誌主要反映的是化學物造成的組織器官損傷、形態改變和功能失調。疾病效應生物學標誌是從暴露到疾病整個過程中最後一組標誌物,與機體亞臨床症狀的出現密切相關,是機體病理狀態的反映。
效應生物學標誌的驗證
 圖1
圖1效應生物學標誌的特徵如圖1。替代終點被定義為在有效的試驗中可能確定性的替代關注的臨床終點的生物學標誌。只有能預測長期的臨床結局和干預效果的效應生物學標誌作為替代終點才有價值。在臨床醫學和藥物的研發中,生物學效應標誌被套用對臨床早期效應鑑定,也有被叫做替代標誌(surrogate markers),然而進一步的研究一致認為,這個術語應該被限於能替代臨床終點的效應生物學標誌,實際上即為替代終點。因此,效應生物學標誌有比較寬泛的含意。
中間效應(即在暴露與疾病之間)的生物學標誌能夠用病例對照研究和佇列研究來驗證。一旦驗證以後,這些生物學標誌可作為疾病的替代終點,雖然因為一般的並不是所有的具有某種生物學標誌的人都會發展為疾病,但是效應標誌高水平組的個體一般具有更大的風險度。一個很好的例子是Hagmar等(1998)關於細胞遺傳生物學標誌和癌症風險度相關性前瞻性的研究。這個研究追蹤了5個歐洲的佇列,表明在具有染色體畸變較高頻率組的受試者總的癌症風險是最低頻率組受試者的兩倍以上。在同一個研究中,在姐妹染色單體交換(SCE)頻率和癌症風險之間未觀察到關聯,而在微核試驗發現不確定的結果。Bonassi等(2000)嵌套的(nested)病例-對照研究發現染色體畸變和癌症之間的關聯表現為與宿主因素如年齡、性別無關,並且不能用暴露於確定的人類致癌物來解釋。
大多數中間效應的生物學標誌缺乏驗證可能是在危險性評定中廣泛使用生物學標誌的最關鍵的障礙。已驗證的效應生物學標誌可用做疾病的替代終點,並成為可以計算的終點,以替代不能計算低頻率的發病率或死亡率。如果使用生物學標誌增加了研究的統計學把握度,可能從流行病學研究獲得較早期的結果。前瞻性流行病學研究是效應生物學標誌驗證的金標準。在前瞻性研究中樣品收集的時間和頻率是很重要的並可能影響驗證。這類研究提供了對有或無特定生物學標誌的個體疾病風險的評估。為了減少時間和經費,正在努力進行大佇列的前瞻性研究和建立生物樣品庫,以同時評價生物學標誌和疾病危險性 。
對一個中間效應生物學標誌驗證程度的測定是暴露經生物學標誌介導的程度,即是否此生物學標誌確實能夠預測臨床疾病,以及未發現此生物學標誌則疾病很少或者不發生。這可以通過計算歸因比例(attributable proportion),也被稱做“人群歸因危險性(population attributablerisk)”或者“病因分數(etiologic fraction)”來進行評估。與特定生物學標誌相關聯的歸因比例,是對經生物學標誌必然進展的患病病例比例的估計,即如果能防止導致生物學標誌的事件,這些病例就不會出現。歸因比例(AP)包括對試驗方法的敏感性(S)的考慮(即,試驗陽性結果發展為疾病的個體數占所有患病的個體的比例)和在該試驗中陽性個體疾病的相對危險性(RR)。歸因比例被定義為:AP=S[1-(1/RR)]。敏感性對於歸因比例是影響最大的因素。歸因比例同時考慮生物學標誌和疾病之間關聯的強度和生物學標誌的流行(prevalence)程度。例如,使用歐洲關於染色體畸變和癌症的研究數據(敏感性46/91=0.50,RR 1.53/0.79=1.93),對於北歐人佇列計算的歸因於染色體損傷的癌症病例比例是24%。
當建立了顯著比例的腫瘤可以歸因於特定的生物學標誌後,關於“干預變數(interveningvariables)”的流行病學原理可以用於檢查生物學標誌真實代表暴露與癌症之間的一個中介事件的範圍。在評價暴露與疾病結局之間的關係過程中,典型的是不使用統計調整方法來調整在暴露與結局間的中間步驟的變數。這樣的調整將會顯著降低或者甚至消除暴露的表觀效應,因為生物學標誌與疾病的關聯是它與暴露關聯的直接結果(假定生物學標誌代表與疾病的開始的暴露相關時期)。利用這種特性可以來評估生物學標誌作為干預變數的作用。如果將對暴露的粗RR(即未經調整RR)與經生物學標誌調整的暴露效應的RR相比較,經生物學標誌的調整減少了表觀暴露效應的程度表明生物學標誌與暴露-疾病關係聯繫的程度。如果暴露的效應的發生主要通過涉及生物學標誌的途徑,那么生物學標誌調整的暴露效應會基本被消除,即調整的RR將接近1.0。在某些情況下,一個生物學標誌很有用,儘管它並不在原因的途徑上。那些是與原因途徑上的某些事件(如:蛋白加合物)相關並且最終導致疾病風險的生物學標誌。
另外一種驗證效應生物學標誌的測量是陽性預測值。對疾病生物學標誌的預測值是在所有具有這種生物學標誌的人群中患有特定疾病的人的比例。預測值不僅是生物學標誌試驗的性質,它是由試驗方法的敏感性和特異性以及疾病的流行度來決定的。這樣,例如一個具有90%特異性和90%敏感性的生物學標誌在關注的疾病患病率只有10%時,它的陽性預測值將只有50%。當假設的關聯被拒絕時,平行的考慮應當延伸至使用陰性預測值。在設計時不考慮流行度的現場研究可能無法檢測效應生物學標誌與疾病之間的關聯,儘管這種關聯可能存在。
陽性預測值與歸因比例反映的是截然不同的事情。從個體的觀點來說,對具有特定生物學標誌的人群中疾病的風險,陽性預測值是很重要的。歸因比例,另一方面,是必須經生物學標誌發展而來的病例的比例,並且如阻斷這個過程就可以預防此病。從環境衛生或者公共衛生的觀點來說這非常重要 。
除了陽性預測值和歸因比例之外,在闡述生物學標誌數據時還有兩個其它概念也很有用,即陰性預測值(見上)和前哨性生物學標誌(sentinel biomarker)。前哨性生物學標誌是可能具有指示環境危害的暴露或者生物學效應啟動的生物學標誌,而不管預測值或歸因比例。
對於生物學標誌作為替代終點的驗證,很多作者提出了標準,較嚴格的標準是Fleming&DeMets(1996)提出的,必須滿足下列條件:①替代終點一定是與真實的臨床結局有關;②替代終點一定完全反映治療對臨床結局的淨效果。以生物學標誌作為替代終點使用需要廣泛的臨床證據,並且,嚴格的科學和統計的評估過程可能是耗時和昂貴的。在許多情況,驗證替代終點到它為主管當局接受需要的時間和努力可能超過直接測量臨床結局花費時間和努力。
對生物學標誌作為替代終點的驗證,缺乏一致性的步驟或指南。然而,一般的方法可總結如下:
1、生物學的合理性應該給使用替代終點提供機制學的基礎。
2、疾病自然史的流行學研究或調查研究在基礎情況下生物學標誌和臨床終點之間建立的統計學相關應該支持此標誌為替代終點。
3、適當的和良好控制的臨床試驗應該,能用數學或機制的方法替代終點的改變提供臨床終點預期利益的估計。適當的劑量-或暴露-反應關係將為替代終點建立補充的支持。
4、分析應考慮包括與替代終點所預測的臨床終點無關的潛在的不良反應。
5、應該發展暴露-反應模型,以數學表述和預測在藥物劑量或血漿濃度和替代終點和臨床的結局之間的關係。
6、生物學標誌和替代終點的發展和驗證應該列入藥物發展過程,先於臨床前期研究。
7、對多項的臨床試驗進行meta分析可能是有幫助的,以確定在研究之間和在研究內各種不同類的藥物和在不同的疾病階段里干預效果的一致性。
雖然有許多有用的生物學標誌,只有少數被驗證作為替代終點(在圖2中表示為生物學標誌的一個四分圓)。
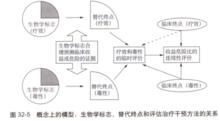 圖2
圖2圖3表示治療干預的有益或有害效應可能不經過生物學標誌獨立地影響臨床終點(以虛線箭頭表示)。不能充分解釋治療效應的生物學標誌不能作為替代終點 。
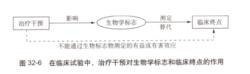 圖3
圖3