放射性滴定
根據滴定過程中溶液的放射性活度對滴定體積變化的轉折點來確定等當點。為此必需採用常規的分離方法,如沉澱法、萃取法、離子交換法等,將反應產物與待測物的溶液分開。
1941年A.蘭格發表了關於放射性滴定法用磷酸氫二鈉溶液定量地測定鎂的工作,比分析化學通常用的重量法迅速而簡單。
最簡單的放射性滴定法是利用生成難溶性沉澱的方法,如:
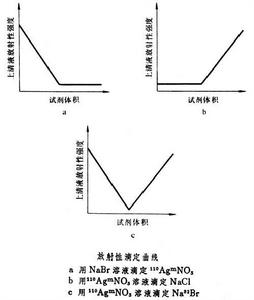
其中AB為待測樣品;CD為滴定劑;A為陽離子,B為陰離子。如果只測定體系中的一個組分,而其他雜質又不影響待測離子的沉澱時,有下列三种放射性滴定曲線:
① 待測物* AB有放射性(*表示有放射性),滴定劑為非放射性物質,在滴定過程中放射性物質* A逐漸形成沉澱,溶液的放射性活度A由於產生* AD沉澱而減小。在等當點以後,溶液的放射性活度幾乎不因滴定劑體積V的增加而變化,只由沉澱的溶解度所決定(圖a)。② 滴定劑C* D有放射性,待測物為非放射性,則滴定曲線如圖b所示。③ 待測物* AB和滴定劑C* D均有放射性,則滴定曲線如圖c所示。
在放射性滴定中,等當點體積可以用作圖法確定,也可用計算法確定。
此外,也有利用第三种放射性核素作為指示劑的放射性滴定法,如滴定Ca2+ 時將樣品的pH調至9.5~11.5,加入用放射性指示劑110 Agm 標記的 AgIO3使其沉澱,然後用EDTA(乙二胺四乙酸)標準溶液滴定。EDTA首先與 Ca2+ 形成絡合物,超過終點即Ca2+ 絡合完時才與110 Agm 絡合,溶液中110 Agm 的放射性迅速增加,由此可以測定Ca2+ 的含量。
放射性滴定的準確度與沉澱的溶解度有關,準確度約為±2%。放射性滴定具有靈敏度高(0.2ppm)、速度快等優點。
配圖
 放射性滴定
放射性滴定
