注意
 摩爾濃度測量儀器
摩爾濃度測量儀器⑵在一定物質的量濃度溶液中取出任意體積的溶液,其濃度不變,但所含溶質的物質的量或質量因體積的不同而不同。
⑶溶質可以是單質、化合物,也可以是離子或其他特定組合。
如C(Cl2)=0.1mol/LC(NaCl)=0.2mol/LC(Fe2+)
⑷溶質的量是用物質的量來表示的,不能用物質的質量來表示
例如:配製1mol/L的氯化鈉溶液時,氯化鈉的式量為23+35.5=58.5,故稱取58.5g氯化鈉,加水溶解,定容至1000ml即可獲得1mol/L的氯化鈉溶液
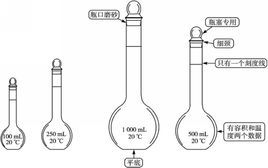
實驗儀器
 容量瓶
容量瓶配製步驟
⑴計算:計算配製所需固體溶質的質量或液體濃溶液的體積。
⑵稱量:用托盤天平稱量固體質量或用量筒(套用移液管,但中學階段一般用量筒)量取液體體積。
⑶溶解:在燒杯中溶解或稀釋溶質,冷卻至室溫(如不能完全溶解可適當加熱)。
⑷轉移:將燒杯內冷卻後的溶液沿玻璃棒小心轉入一定體積的容量瓶中(玻璃棒下端應靠在容量瓶刻度線以下)。
⑸洗滌:用蒸餾水洗滌燒杯和玻璃棒2~3次,並將洗滌液轉入容器中,振盪,使溶液混合均勻。
⑹定容:向容量瓶中加水至刻度線以下1cm~2cm處時,改用膠頭滴管加水,使溶液凹面恰好與刻度線相切。
⑺搖勻:蓋好瓶塞,用食指頂住瓶塞,另一隻手的手指托住瓶底,反覆上下顛倒,使溶液混合均勻。
⑻裝瓶貼簽:最後將配製好的溶液倒入試劑瓶中,貼好標籤。
注意事項
⑴只能配製容量瓶上規定容積的溶液。
⑵轉移溶液時玻璃棒要靠在刻度線以下。
⑶如果加水定容超過了刻度線,不能將超出部分吸走,而應重新配製。
⑷用膠頭滴管定容時,眼睛應平視液面。
⑸搖勻後若出現液面低於刻度線的情況,不能再加水。
誤差分析
| 可能引起誤差的操作 | m(n) | V | c/mol·L^-1 |
| 1、藥品、 砝碼位置左右顛倒(使用了游碼) | 減小 | 不變 | 偏小 |
| 2、稱量易潮解的物質(如NaOH)時間過長 | 減小 | 不變 | 偏小 |
| 3、溶質中含有雜質 | 減小 | 不變 | 偏小 |
| 4、用量筒量取液體(此處液體指溶質為液體,下同)時仰視讀數 | 增大 | 不變 | 偏大 |
| 5、用量筒量取液體時俯視讀數 | 減小 | 不變 | 偏小 |
| 6、溶解前燒杯內有水 | 不變 | 不變 | 無影響 |
| 7、攪拌時部分液體濺出或向容量瓶轉移液體時有少量液體流出 | 減小 | 不變 | 偏小 |
| 8、未洗滌燒杯和玻璃棒 | 減小 | 不變 | 偏小 |
| 9、未冷卻至室溫就注入容量瓶 | 不變 | 減小 | 偏大 |
| 10、定容時,水加多了,用滴管吸出 | 減小 | 不變 | 偏小 |
| 11、定容搖勻後,發現液面下降,再加水 | 不變 | 增大 | 偏小 |
| 12、定容時,仰視刻度線 | 不變 | 增大 | 偏小 |
| 13、定容時,俯視刻度線 | 不變 | 減小 | 增大 |
微粒濃度
1、非電解質在其水溶液中以分子形式存在,溶液中溶質微粒的濃度即為溶質分子的濃度。
如1mol/L乙醇溶液中,乙醇分子的物質的量濃度為1mol/L。
2、強酸、強鹼、可溶性鹽等強電解質在其水溶液中以陰離子和陽離子形式存在,各種微粒的
濃度要根據溶液的濃度和溶質的電離方程式來確定。
如:1mol/LNaCl溶液中:C(Na+)=1mol/LC(Cl-)=1mol/L
1mol/LH2SO4溶液中:C(H+)=2mol/LC(SO42-)=1mol/L
1mol/LBa(OH)2溶液中:C(Ba2+)=1mol/LC(OH-)=2mol/L
1mol/LFe2(SO4)3溶液中:C(Fe3+)=2mol/LC(SO42-)=3mol/L
量濃度
1、關於物質的量濃度概念的計算
由CB=nB/V
可得CB=(m/M)/V=m/MV
注意:其中V指的是溶液的體積,而不是溶劑的體積。
2、溶液中溶質的質量分數與溶質的物質的量濃度的換算。
二者都表示溶液的組成,可以通過一定關係進行相互換算。
將溶質的質量分數換算成物質的量濃度時,首先要計算1L溶液中含溶質的質量,換算成相應物質的量,有時還需將溶液的質量換算成溶液的體積,最後才換算成溶質的物質的量濃度。
將溶質的物質的量濃度換算成溶質的質量分數時,首先要將溶質的物質的量換算成溶質的質量,有時還將溶液的體積換算成質量,然後換算成溶質的質量分數。
n=m/M=V·ρ·ω·1000/M
C=n/v
C=(V·ρ·ω/M)/V=V·ρ·ω/MV=ρ·ω/M
[式中:ρ—溶液的密度,單位為g/mL或g/cm3
ω—溶質的質量分數
M—溶質的摩爾質量,數值等於物質的式量
1000—指1000mL溶液
以下公式所用與此相同。
推斷過程:假設取1L溶液,則:C=ρ·ω·1000/M
若題目中出現了溶解度S,則可用代入上兩個公式,得:C={1000·ρ·(S/100+S)}/M
[式中S—某溫度下的溶解度,以g為單位;100—指100g水]
3、一定物質的量濃度溶液的稀釋
由溶質的物質的量在稀釋前後不變得C1V1=C2V2
(C1、C2為稀釋前後溶質的物質的量濃度)。
4、不同物質的量濃度溶液的混合計算
物質的量濃度相近時,可以近似看成混合後溶液體積不變。
混合後溶液體積不變時C1V1+C2V2=C3(V1+V2)。
混合後溶液體積改變時C1V1+C2V2=C3V3
稀釋定律:C濃V濃=C稀V稀(高中)
m濃W濃=m稀W稀(國中)
5.關於物質的量濃度與質量分數的轉化(推導和演化)
C=ρ·ω·1000/M
其中,C:物質的量濃度(單位mol/L)
ω:溶液的密度,(形式為質量分數,<1)
ρ:密度,(單位g/mL)
M:物質的摩爾質量,(單位g/mol)
c=n/V
n(溶質的物質的量)=ω*m(溶液質量)/M
m(溶液質量)=ρ·V
溶液的溶質質量=ω(質量分數)·ρ(密度)·V
故,n(溶質的物質的量)=ω·ρ·V/M
C=n/V
=(ω·ρ·V/M)/V
=ω·ρ·V/MV
=ω·ρ/M
若密度ρ單位為1000kg/m^3(國際單位)=1g/cm^3