成份
 愛若華
愛若華主要成份為來氟米特。
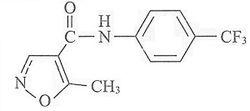
其化學名為α,α,α-三氟-5-甲基-異噁唑-N-醯基-對甲苯胺。
其化學結構式為:
分子式:CHFNO
分子量:270.2
性狀
本品為薄膜衣片,除去包衣後顯白色。
適應症
(1)適用於成人類風濕關節炎,有改善病情作用。(2)狼瘡性腎炎。
規格
(1)10mg (2)20mg
用法用量
(1)成人類風濕關節炎:口服。由於來氟米特半衰期較長,建議間隔24小時給藥。為了快速達到穩態血藥濃度,參照國外臨床試驗資料並結合I期臨床試驗結果,建議開始治療的最初三天給予負荷劑量一日50mg,之後根據病情給予維持劑量一日10mg或20mg。在使用本藥治療期間可繼續使用非甾體抗炎藥或低劑量皮質類固醇激素。
(2)狼瘡性腎炎:口服。根據病情選擇適當劑量,推薦劑量一日一次,一次20-40mg,病情緩解後適當減量。可與糖皮質激素聯用,或遵醫囑。
不良反應
用於類風濕性關節炎的治療:主要有腹瀉、瘙癢、可逆性肝臟酶(ALT和AST)升高、脫髮、皮疹等。在國外臨床試驗中,來氟米特治療1339例類風濕關節炎病人中,發生率≥3%的不良事件包括:乏力、腹痛、背痛、高血壓、厭食、腹瀉、消化不良、胃腸炎、肝臟酶升高、噁心、口腔潰瘍、嘔吐、體重減輕、關節功能障礙、腱鞘炎、頭暈、頭痛、支氣管炎、咳嗽、呼吸道感染、咽炎、脫髮、瘙癢、皮疹、泌尿系統感染等。以上不良事件均在安慰劑對照或陽性對照柳氮磺胺吡啶治療組及MTX治療組中發現,其中來氟米特治療組以腹瀉、肝臟酶升高、脫髮、皮疹較為明顯,在套用過程中應加以注意。
用於狼瘡性腎炎的治療:國內臨床試驗資料顯示,來氟米特治療108例活動增殖型狼瘡腎炎病人中,前6個月(20-40mg/日),共有43人發生與試驗藥物可能有關/有關的不良反應,發生率為39.81%;治療期間,發生率≥3%的不良事件包括:脫髮、血壓升高、帶狀皰疹、轉氨酶升高、腹瀉/稀便、白細胞下降、皮疹、月經不調、心悸、腹痛;發生率[3%的不良事件包括:噁心/嘔吐、上呼吸道感染、血小板下降、乏力、胃燒灼感、厭食、發熱、牙周疼痛、視覺異常、尿路感染、咽痛、巨細胞病毒感染、體重下降、多毛、肺部感染等。治療7-72個月(10-30mg/日),隨訪52例患者,共有12人發生與試驗藥物可能有關/有關的不良反應,發生率為23.08%,發生率≥3%的不良事件包括:白細胞下降、轉氨酶升高、血小板減少;發生率[3%的不良事件包括:上呼吸道感染、脫髮、帶狀皰疹、月經不調、尿路感染。
禁忌
對本品及其代謝產物過敏者及嚴重肝臟損害患者禁用。
注意事項
(1)臨床試驗發現來氟米特可引起一過性的ALT升高和白細胞下降,服藥初始階段應定期檢查ALT和白細胞。檢查間隔視病人情況而定。
(2)有肝臟損害和明確的B肝或C肝血清學指標陽性的患者慎用。用藥前及用藥後每月檢查ALT,檢測時間間隔視病人具體情況而定。如果用藥期間出現ALT升高,調整劑量或中斷治療的原則:①如果ALT升高在正常值的2倍([80U/L)以內,繼續觀察。②如果ALT升高在正常值的2-3倍之間(80-120U/L),減半量服用,繼續觀察,若ALT繼續升高或仍然維持80-120U/L之間,應中斷治療。③如果ALT升高超過正常值的3倍(]120U/L),應停藥觀察。停藥後若ALT恢復正常可繼續用藥,用時加強護肝治療及隨訪,多數病人ALT不會再次升高。
(3)免疫缺陷、未控制的感染、活動性胃腸道疾病、腎功能不全、骨髓發育不良(bone marrow dysplasia)的患者慎用。
(4)如果服藥期間出現白細胞下降,調整劑量或中斷治療的原則如下:①若白細胞不低於3.0×109/L,繼續服藥觀察。②若白細胞在2.0×109/L~3.0×109/L之間,減半量服藥觀察。繼續用藥期間,多數病人可以恢復正常。若複查白細胞仍低於3.0×109/L,中斷服藥。③若白細胞低於2.0×109/L,中斷服藥。建議粒細胞計數不低於1.5×109/L。
(5)準備生育的男性應考慮中斷服藥,同時服用考來烯胺(消膽胺)。
(6)在本品治療期間接種免疫活疫苗的效果和安全性沒有臨床資料,因此服藥期間不應使用免疫活疫苗。
(7)據國外報導,該藥在國外上市後罕見間質性肺炎的發生,有肺部疾患者,請慎用或遵醫囑。
孕婦及哺乳期婦女用藥
孕婦及尚未採取可靠避孕措施的育齡婦女及哺乳期婦女禁用。
兒童用藥
對兒童套用本品的療效和安全性還沒有研究,故年齡小於18歲的患者,建議不要使用本品。
老年用藥
未進行該項實驗且無可靠參考文獻。
藥物相互作用
據文獻資料報導:
(1)考來烯胺和活性炭 13例患者和96例志願者給予考來烯胺或活性炭,血漿中M1濃度很快減少。
(2)肝毒性藥物 來氟米特和其它肝毒性藥物合用可能增加不良反應,同時也應考慮到雖然中斷來氟米特治療,但沒有採取藥物消除措施就接著服用這些藥物,同樣有可能增加不良反應。在小樣本(30例)來氟米特和MTX聯合用藥的研究中,有5例肝臟酶出現2-3倍升高。其中2例繼續服用,3例中斷來氟米特治療,酶的升高都得到恢復。另外5例升高大於3倍,其中2例繼續服用,3例中斷來氟米特治療,酶的升高也都得到恢復。
(3)非甾體抗炎藥物 在體外一系列臨床研究中,M1可使血漿游離雙氯芬酸和布洛芬的濃度升高13%-50%,此臨床意義還不清楚。但在臨床試驗中曾觀察了許多和非甾體藥物同時套用的病例,沒有發現有特殊影響。
(4)甲苯磺丁脲 在一系列臨床研究中發現,M1可使血漿游離甲苯磺丁脲濃度升高13%-50%,此臨床意義還不清楚。
(5)利福平 單劑量來氟米特和多劑量利福平聯合使用,M1峰濃度較單獨使用來氟米特升高(約40%),由於隨著利福平的使用,M1濃度可能繼續升高,因此當兩藥合用時,應慎重。
藥物過量
據文獻報導,如果劑量過大或出現毒性時,可給予考來烯胺或活性炭加以消除。方法:
(1)口服考來烯胺(8g,3次/24小時),24小時內M1血漿濃度降低約40%,48小時內降低大約49%-65%。連續服用11天,M1血漿濃度可降至0.02µg/ml以下。
(2)通過胃管或口服給予活性炭(混懸液),每6小時50克,24小時內M1血漿濃度降低37%,48小時降低48%。如果臨床上需要,這些措施可以重複使用。
臨床試驗
國內來氟米特治療狼瘡性腎炎III期臨床試驗,採用多中心、隨機、平行對照臨床研究。共入組患者184例,其中試驗組(來氟米特)108例,對照組(環磷醯胺)76例。
患者入組標準:年齡18-65歲;狼瘡性腎炎腎活檢病理類型為III、IV或伴V型;病情有活動性,SLEDAI狼瘡活動積分≥8分;持續性蛋白尿(≥1g/24h)、鏡下血尿;3個月內未用過CTX等細胞毒藥物。
治療方案:試驗組:口服來氟米特片,試驗開始3天0.8-1.0mg/Kg/日,以後20-40mg/日維持。對照組:靜脈注射環磷醯胺,劑量為0.8-1.0g/月,每月1次。聯合激素:口服強的松,劑量0.8mg/Kg/日(一般在40-60mg/日),1個月後改為0.5mg/Kg/日,然後逐漸減量(每2周減2.5-5mg)至維持量5-10mg/日。療程6個月。
療效判定標準:完全緩解:24小時尿蛋白定量小於0.3g,且尿沉渣(RBC[5/HP,WBC[5/HP)、血清白蛋白、血清SCr及CCr檢測均正常。部分緩解:24小時尿蛋白定量介於0.3-3g之間,且下降≥50%,且血清白蛋白≥30g/L,且腎功能穩定。治療失敗:24小時尿蛋白定量下降[50%;或24小時尿蛋白定量介於0.3-3g之間,但血清白蛋白[30g/L;或血清SCr上升及CCr下降幅度超過基礎值的15%。
療效
綜合療效評價:治療6個月後,試驗組完全緩解22.22%,部分緩解59.60%;對照組分別為18.84%,62.32%;治療6個月,同基線水平相比,試驗組和對照組均能顯著降低SLEDAI評分、降低24小時尿蛋白、提高血清白蛋白、降低SCr、提高C3、降低ds-DNA陽性率。
試驗入組病例活檢的病理類型為狼瘡腎炎的III型、IV、或伴有V型。其中試驗組15例病例在治療6個月後進行了重複腎活檢。結果顯示,經來氟米特治療後,13例患者狼瘡腎炎的活動性降低,急性活動指數下降。其中,7例患者治療前為III、IV型,經來氟米特治療後全部轉變為病理類型較輕的II型。
不良反應
與藥物可能有關/有關的不良反應發生率,試驗組為39.81%,對照組為55.26%。試驗組發生率≥3%的不良事件包括:脫髮、血壓升高、帶狀皰疹、轉氨酶升高、腹瀉/稀便、白細胞下降、皮疹、月經不調、心悸、腹痛;發生率[3%的不良事件包括:噁心/嘔吐、上呼吸道感染、血小板下降、乏力、胃燒灼感、厭食、發熱、牙周疼痛、視覺異常、尿路感染、咽痛、巨細胞病毒感染、體重下降、多毛、肺部感染等。
III期臨床試驗結束後,試驗組52例患者自願繼續服用試驗藥物,服藥劑量為10-30mg/日;治療9個月後,90%的患者服藥劑量減為10-20mg/日。平均隨訪時間32.7±18.2月,最長觀察時間為72個月;治療6個月時,52例患者完全緩解率為36.5%,部分緩解率為44.2%;經過7-72個月的繼續治療,完全緩解率為59.6%,部分緩解率為30.6%。臨床觀察期間,共有12人發生與試驗藥物可能有關/有關的不良反應,發生率為23.08%,發生率≥3%的不良事件包括:白細胞下降、轉氨酶升高、血小板減少;發生率[3%的不良事件包括:上呼吸道感染、脫髮、帶狀皰疹、月經不調、尿路感染。
藥理毒理
本品為一個具有抗增殖活性的異噁唑類免疫抑制劑,其作用機理主要是抑制二氫乳清酸脫氫酶的活性,從而影響活化淋巴細胞的嘧啶合成。體內外試驗表明本品具有抗炎作用。來氟米特的體內活性主要通過其活性代謝產物A771726(M1)而產生。
藥代動力學
本品口服吸收迅速,在胃腸黏膜與肝中迅速轉變為活性代謝產物A771726(M1),口服後6-12小時內A771726的血藥濃度達峰值,口服生物利用度(F)約80%,吸收不受高脂肪飲食影響。單次口服50mg或100mg後24小時,血漿A771726濃度分別為4µg/ml或8.5µg/ml。A771726主要分布於肝、腎和皮膚組織,而腦組織分布較少;A771726血漿濃度較低,血漿蛋白結合率大於99%,穩態分布容積為0.13L/Kg。A771726在體內進一步代謝,並從腎臟與膽汁排泄,其半衰期約10天。
貯藏
避光,密閉,於乾燥處保存。
包裝
(1)10mg複合鋁箔包裝,10片/板×1板/盒;10片/板×2板/盒;8片/板×2板/盒;8片/板×4板/盒;8片/板×6板/盒;(2)20mg複合鋁箔包裝,10片/板×1板/盒;10片/板×2板/盒;8片/板×2板/盒。
有效期
(1)10mg 36個月 (2)20mg 24個月
執行標準
《中國藥典》2010年版二部
批准文號
(1)10mg 國藥準字H20000550
(2)20mg 國藥準字H20050129
生產企業
蘇州長征-欣凱製藥有限公司
核准日期
2007年03月06日
修訂日期
2010年10月01日

