微流式細胞分析術 - 概述
 微流式工作原理
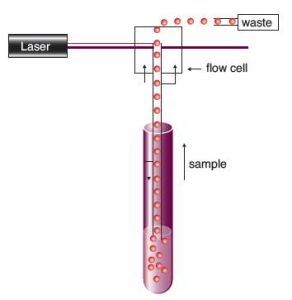
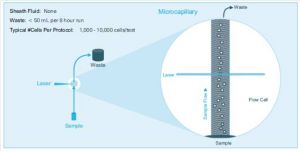
微流式工作原理 基於傳統流式細胞術,微流式細胞分析術改進了其複雜的液流系統,採用微毛細管技術提高上樣效率,顯著減少樣品用量,摒棄了傳統的鞘液流方式。由於微毛細管設計,使每次實驗僅需消耗1000-10000個細胞/Test。精確的上樣體積使得絕對細胞計數成為可能。
微毛細管技術:樣品上樣時,由微毛細管與樣品液體接觸的橫截面中心形成的負壓區,形成單細胞流上行。注射泵提供穩定精確的上樣流與上樣體積。由微毛細管和注射泵協同作用形成的單細胞流更加精確與穩定。運行8小時只產生不到50ml的廢液;允許檢測樣本最小上樣量僅為1000個細胞;同時無鞘液系統的液流系統成固定狀態,儀器操作簡單,縮短學習時間,從而提高研究效率。
微流式細胞分析術具備如下特點:
> 穩定的單細胞流,進樣過程完全摒棄了鞘液流
> 樣本需求少至1000Cells/Test,支持低濃度樣本檢測10Cells/μl
> 最低實驗樣本需求量10μl
微流式細胞分析術 - 簡史
17世紀第一台顯微鏡誕生後,人們開始套用於細胞和組織切片的檢查,從此拉開了人類對細胞的科學研究的序幕。到了19世紀末,人們已經可以通過對細胞染色,在顯微鏡下對細胞的結構進行形態學的研究。到了20世紀40-50年代,由於技術的進步,出現了更先進和更靈敏的螢光顯微鏡,再加上抗體技術的進展,螢光標記的抗體技術被廣泛套用。這一時期單克隆抗體技術的出現,使得人們可以對細胞的表面特異抗原進行識別。人們不僅可以從形態學上對細胞進行分類,更可以根據細胞的特異標誌進行細胞亞型的精確分類,以進行更深入的研究。
1934年AndrewMoldaran實現了讓懸浮的單個血紅細胞通過玻璃毛細管,在亮視野下用顯微鏡進行計數,並在顯微鏡的目鏡上用光電記錄裝置對通過的每一個細胞進行計數測量。其後LouisKamentsky及Melamed等人又對這一技術進行了了的進一步改進。隨著20世紀50年代到80年代的發展,流式細胞術被廣泛套用於細胞研究,並朝著多參數分析的方向發展。
但隨後的20多年裡,該技術並無實質性改進。同時由於採用了鞘液流系統和複雜的光路系統,使得機器體積較大,並且加上複雜的軟體系統,機器日常使用很不方便,常需要專人對機器進行維護和使用,這就大大限制了流式細胞術在普通實驗室的套用。
直到1998年PhillipeGoix博士將最新的微毛細管技術引入流式細胞儀,開創了流式細胞儀的革命性創新。2009年,改進的微毛細管液流系統結合了最新的雙雷射同步共線性設計,使得機器體積大大減小,再加上創新設計的智慧型化模組軟體系統,讓流式細胞術變得更為簡單。
微流式細胞術 - 原理
流式細胞術待測樣品(如細胞、微生物、精子或細菌等)經螢光染料染色後製成樣品懸液,由微毛細管與樣品液體接觸的橫截面中心形成的負壓區,形成單細胞流上行,排成單列的細胞成為單細胞液流,並與入射雷射束相交。細胞被激發而產生螢光,通過濾光片組合和光電倍增管進行信號收集。
整個儀器用多道脈衝高度分析器處理螢光脈衝信號和光散射信號。測定的結果用單參數直方圖和雙參數散點圖來表示。
微流式細胞術 - 套用
免疫學檢測
 微流式細胞術-免疫學檢測
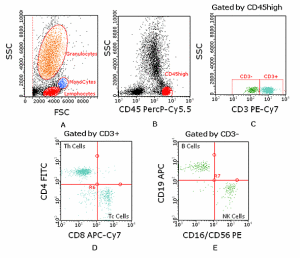
微流式細胞術-免疫學檢測免疫系統是由免疫器官、免疫組織、免疫細胞及免疫分子組成。體內的免疫細胞通常處於靜止狀態,細胞必須被活化,經免疫應答過程,產生免疫效應細胞,釋放免疫效應分子,才能執行免疫功能。免疫細胞分為兩類,一類是固有免疫應答細胞,如單核-巨嗜細胞,自然殺傷細胞、多形核中性粒細胞等。另一類是適應性免疫應答細胞:即淋巴細胞,包括T細胞及B細胞。檢測各群體淋巴細胞的數量與功能是觀察機體免疫狀態的重要手段。
右圖1,微流式細胞分析術對淋巴細胞亞群進行區分。圖A:全血細胞在FSC與SSC散點圖中可分為淋巴細胞、單核細胞和粒細胞。圖B:CD45High為淋巴細胞群。圖C:CD45+CD3+為T淋巴細胞,CD45+CD3-為非T淋巴細胞。圖D:CD3+CD4+為Thelp細胞,CD3+CD8+為Tcytotoxic細胞。圖E:CD45+CD19+為B淋巴細胞,CD16+CD56+為NK細胞。
細胞凋亡研究
 微流式細胞術-細胞凋亡檢測
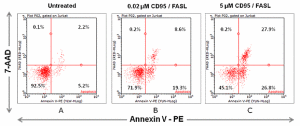
微流式細胞術-細胞凋亡檢測細胞凋亡,即細胞程式性死亡。細胞表面受體、配體、蛋白酶、有絲分裂組分等多種蛋白,這些凋亡信號在細胞內的傳遞調節著細胞的生存與死亡的精細平衡。這個過程包括了:細胞膜上磷脂醯絲氨酸的外翻,線粒體膜電位去極化,胞內蛋白降解,DNA片段化,細胞膜選擇通透性喪失,細胞皺縮等。對凋亡的逃逸,是絕大多數癌症的特徵。因此,對凋亡途徑的研究有助於找到癌症藥物靶點,並分析藥物治療效果。
右圖2,微流式細胞分析術檢測jurkat細胞的早期凋亡信號。圖A:Jurkat細胞未受凋亡誘導,正常組;圖B:0.02μmCD95/FASL刺激誘導凋亡;圖C:5μMCD95/FASL刺激誘導凋亡。凋亡誘導後用Nexin進行染色。從結果來看,當誘導劑劑量增加,凋亡細胞比例逐漸增加,而活細胞比例由92.5%下降到45.1%。
細胞周期研究
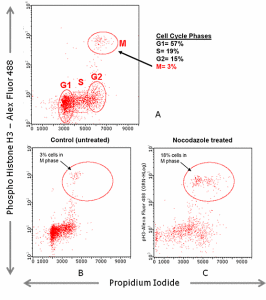 微流式細胞術-細胞周期檢測
微流式細胞術-細胞周期檢測細胞周期是指連續分裂細胞從一次有絲分裂結束到下一次有絲分裂結束所經歷的整個過程。在這個過程中,細胞遺傳物質複製並加倍,且在分裂結束時平均分配到兩個子細胞中去。細胞周期分為DNA合成前期(G1期),DNA合成期(S期),DNA合成後期(G2期)和分裂期(M期)。細胞周期是調控細胞正常生長、分裂的重要事件。細胞周期的研究有助於揭示抗腫瘤製劑的作用機制。在腫瘤細胞增殖中,細胞周期的調控失效,使細胞無限分裂;反之,若細胞周期調控正常則可迫使細胞從活躍的生長分裂期進入靜止的G0期。使用流式細胞儀分析細胞周期的變化已非常普遍。
右圖3,微流式細胞分析術檢測Jurkat細胞周期。圖A使用PhosphoHistoneH3–AlexFluor®488(pH3)與PI復染區分G2期與M期。pH3陽性為M期細胞。在pH3陰性細胞中,PI所指示的DNA含量區分G1期,S期與G2期。圖B正常細胞周期與圖C細胞周期阻滯的比較。Jurkat細胞在Nocodazole作用下,M期的細胞增加,由正常的3%上升到18%。
活細胞絕對計數
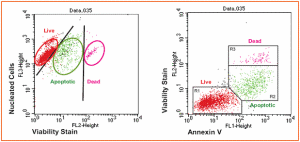 微流式細胞術-活細胞絕對計數
微流式細胞術-活細胞絕對計數細胞計數法是用來對細胞懸液中的活細胞、死細胞進行絕對數量計數的一種方法。最早的細胞計數法源於對血細胞計數的需求。法國組織學家Louis-CharlesMalassez於19世紀研發的血球計數板是最早的細胞計數器,通過台盼藍染色區分死細胞與活細胞。隨著對細胞生物學的研究不斷深入,科學家開始發現台盼藍並不能區分凋亡細胞與壞死細胞。同時,活細胞的計數結果是通過計算細胞總數和死細胞數獲得的。其中任何一個數據不準確,就會導致活細胞計數結果的誤差。這種憂慮促成了科學家從20世紀50年代以來,不斷對細胞計數儀的開發與探索。
右圖4,微流式細胞分析技術同時對活細胞、死細胞、凋亡細胞的絕對計數。左圖Viacount法檢測,右圖AnnexinV法作為對照。
此外,微流式細胞術在幹細胞研究、藻類研究、線粒體研究等領域中也得到廣泛的套用。微流式細胞術正在向低成本、高性能、小型化、易用型、獲取形態學信息等方向發展。
參考文獻:
 微流式細胞術參考文獻
微流式細胞術參考文獻