概述
有人認為MA 起源於
生腎原始細胞。也有研究認為乳頭狀腎細胞癌和MA 之間有密切聯繫可發生於任何年齡, 以50~ 60 歲多見, 男女之比約1 : 2, 一般單側受累。1992 年Brisicotti 首先命名了 後腎腺瘤( Metanephricadenoma,MA) ,是一種十分罕見的腎原發腫瘤,其邊界清楚,具有獨特的病理組織學結構,約占成人腎上皮腫瘤0. 2%,屬於最新WHO( 2004) 腎臟腫瘤分類中“後腎腫瘤”大類。
臨床症狀
大多數患者無明顯症狀及體徵, 50%的病例為偶然發現, 約10% 的患者可伴有紅細胞增多症, 可表現為腰腹部疼痛、血尿、腫塊及間歇性發熱等, 可伴有遺傳性假性血友病相關症狀。MA 腫塊大小不一, 直徑多為30~ 60 mm。
病理學特徵
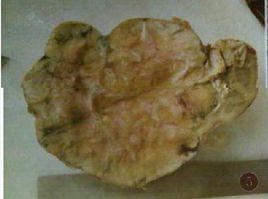
大體病理
MA 大小的差異十分顯著,最常見的直徑為30 ~ 60mm,少見多灶性。典型者腫瘤邊界清楚,無包膜,切面可呈灰色,褐色及黃色,質地軟或硬。常見灶狀出血和壞死,約20% 腫瘤內有鈣化[1], 10%腫瘤內有小囊腔。Obulareddy 等報導是有包膜,且包膜完整。
鏡下結構
鏡下主要有以下結構: 小腺泡狀結構:這是腫瘤組織學特徵之一。腫瘤細胞密集或散在分布,部分排列成小腺泡狀結構,腫瘤體積較小,胞漿少,核圓形或橢圓形,略大於淋巴細胞,大小一致。核仁不明顯,無明顯異型性,無核分裂像或者罕見核分裂像。 管狀結構: 部分細胞排列成長條狀,分支管狀結構。 乳頭狀結構: 也為
常見結構之一。 腎小球及花蕾狀結構: 在稍大一些的腔隙內細胞堆積成球團狀,類似新生兒腎小球結構。如分化差時細胞密集排列呈同心圓狀細胞團,似花蕾樣。此兩種特殊形狀是本瘤所具有的獨特結構,具有診斷和鑑別診斷價值。 微囊結構: 部分病例中可見局灶性大小不等的,形狀不規則的腔隙樣結構,其所占比例各不相同。少數病例以此種結構為主,類似多囊腎,但其囊與囊之間或周圍組織中總能見有上述小圓形細胞及小腺泡
狀結構。 間質: 淡染,無或極少細胞,分布在小腺泡之間,不含後腎胚芽,組織結構類似腎母細胞瘤的錯構瘤成分。部分腫瘤出現壞死、少量沙粒體。
電鏡檢查
瘤細胞大小相對一致,不成熟,核無極性,細胞漿內細胞器( 線粒體、核糖體、粗面內質網) 稀少,排列成小管狀或花環狀的上皮細胞構成。上皮細胞腔面有微絨毛,腫瘤性小管周圍有較為豐富的基底膜圍繞,細胞間存在細胞連線。並可見細胞頂端的微絨毛及分泌顆粒。
免疫表型
有關MA 免疫表型特點的研究各文獻報導不一。近年研究發現多數病例WT1、CD57、Vimentin 瀰漫陽性表達,CK7 灶性陽性或陰性表達,而CD56,CS - 100,NSE,CEA,CgA,Syn,AFP,Actin,Desmin,HMB45,AMACR 表達陰性。部分病例偶見α - 胰蛋白酶、MSA 陽性,EMA 多陰性。其中WT 基因WT1 編碼一種作為轉錄激活子
和腫瘤抑制因子的蛋白,是調節正常胚胎腎臟、卵巢和睪丸發育的重要因子。WT1 主要見於包括發育中的腎單位、間皮等胚胎組織。在腎腫瘤主要見於Wilms 瘤,WT1 在MA 的表達提示MA 和Wilms 瘤在組織發生上可能有一定的關聯。WT1在MA 的亦有陰性表達,本例WT1 亦呈陰性。CD57 為一種糖蛋白,見於發育中腎單位近腎小球
的近曲小管及成人近曲小管,腎腫瘤中已見MA、部分腎透明細胞癌、腎類癌的表達的報導。又報導α - 甲基- CoA 消旋酶( AMACR) 染色可以作為MA 鑑別診斷重要指標,MA 多呈陰性表達,在大多數乳頭狀腎細胞癌( PRCC) 均有強的表達。有學者比較了PRCC、Wilms 瘤和MA 免疫組化特點: AMACR 多在PRCC 表達陽性,而Wilms 瘤和MA 陰性。與之相反WT1 在Wilms 瘤和MA 多表達陽性,而PRCC 陰性。故AMACR、WT1 可用於PRCC 與Wilms 瘤、MA 的鑑別。
分子遺傳學
關於MA 有無染色體的異常,文獻一直存在爭論。Brown 等人對11 例MA進行了FISH 研究,結果證實MA 存在7, 17 號染色體異常及性染色體( X 或Y) 的丟失,因此認為MA與腎乳頭狀細胞癌有相關性,但大多數文獻及WHO 腫瘤分類中( 2004 ) 表明MA 無染色體異常[6,8]。研究同時表明,MA 並不存在Wilms 瘤所特有的遺傳學染色體11P13 等位基因失衡,說明MA 與Wilms 瘤在遺傳學上是完全不同的腫瘤實體。
影像學資料
超聲檢查
多為界清、類圓形、低或高回聲的實性腫塊, 可有液性暗區及周圍低回聲環;囊腫樣表現者罕見。
CT檢查
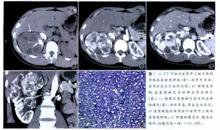 後腎腺瘤CT表現
後腎腺瘤CT表現CT 平掃腫瘤邊緣清晰, 相對周圍腎臟實質多為低密度、等密度或均勻性高密度, 可有斑片狀出血、壞死囊變區及點狀鈣化, 增強後實質部分多無或輕度強化, 還可有延遲增強表現。
MR檢查
MRT1WI 多呈低信號, T2WI 低或稍高信號。大多數MA 經單純腫塊切除術後即可治癒。文獻中有轉移到骨和淋巴結的報導, 因此手術切除後應行長期影像學監測和隨訪。臨床若遇到腎臟腫塊並伴有紅細胞增多症及相對典型的CT 表現, 應想到M A 可能。
治療與預後
MA 是一種相對良性的腫瘤。預後較好。但在臨床工作中,因為該腫瘤難以與惡性腫瘤鑑別,故多行根治性腎臟切除,而在術後病理得到確診。大多數觀點認為該腫瘤經隨訪無復發及轉移,預後良好。但也有數篇文獻報導存在局部轉移的病例[9 - 11],WHO( 2004) 對其生物學特性亦無明確表示,僅提到存在不止1 例病例有局部轉移,但無進一步發展,其中1 例MA 中出現肉瘤成分,提示其生物學行為的不確定性。因此,MA 並不能完全認為是良性病變,應長期密切隨訪。