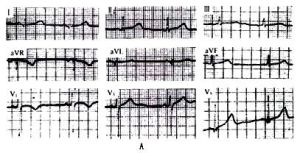
概述
尖端扭轉型室性心動過速(torsadesdepointes,TDP)簡稱尖端扭轉型室速,是一種特殊類型的多形態快速性室性心律失常,臨床分兩種情況:一為尖端扭轉型室速並Q-T間期延長,其中少部分尖端扭轉型室速形態可不典型;二為尖端扭轉型室速不並Q-T間期延長。因其發病機制和治療等有較大差異,多數學者將前者稱為“尖端扭轉型室速”
病因
(一)發病原因
尖端扭轉型室速分為先天性和獲得性兩種。
1.先天性Q-T間期綜合徵並尖端扭轉型室速多為腎上腺素依賴性,LQTS三基因所致者為長間歇依賴性,多有家族史,為常染色體顯性遺傳,亦可呈特發性,由情緒緊張,應激,運動或β受體興奮劑誘發,以兒童和少年多見,亦見於新生兒,Hofbeck發現9例胎兒期心動過緩,生後即為長Q-T間期綜合徵,並發尖端扭轉型室速,暈厥。
2.獲得性Q-T間期延長並尖端扭轉型室速此型多見,多為長間歇依賴性,病因包括低血鉀,低血鈣,低血鎂等電解質紊亂,抗心律失常藥及洋地黃中毒,心動過緩,中樞神經系統疾病,器質性心臟病等。
(二)發病機制
特發性長QT綜合徵(LQTS)由於遺傳因素髮病,近年的分子遺傳學研究證實LQTS與編碼心肌細胞離子通道蛋白的基因突變有關,迄今已證實至少有3個致病基因存在,即第3,7,11號染色體上SCN5A,HERG及KVLQT1基因的突變,此外,可能還有另2個疾病基因,SCN5A編碼合成心肌的鈉通道蛋白,該基因的突變使編碼的通道蛋白功能增強,使鈉通道失活門不穩定,形成了動作電位時限中反覆的通道開放,鈉離子內流,使動作電位時限延長(QT延長),並出現快速心律失常,HERG司管鉀通道蛋白的合成,突變後的HERG使編碼的鉀通道蛋白功能降低,即通道阻滯,使復極延遲,動作電位時限延長,從而誘發折返或觸發活動,KVLQT1編碼蛋白的生理功能尚未明確,反互補DNA預測的胺基酸序列提示,該蛋白是新鉀通道族中的成員,雖然,SCN5A和HERG突變的分子生物學基礎相異,但它們在細胞和功能上的後果相同,即心肌復極延遲,細胞電穩定性降低,目前上述LQTS分子生物學上的突破已套用於臨床研究,並取得了有意義的成果,LQTS的心肌復極的異常延長,導致後電位的形成,可觸發室性心動過速,另外,經動物實驗和臨床觀察,患者多由情緒負荷或體力負荷時發生室性心律失常導致猝死,採用β阻滯藥或左側心臟交感神經節切除術有一定療效,多年來認為交感神經不平衡為本病發病機制之一。
治療
(一)治療
TDP是介於室速和室顫之間的一種室性心律失常,也是Q-T間期延長伴發的一種特殊類型的心律失常。可由不同的病因引起,發作時因心室率極快,心排出量銳減可致暈厥、抽搐及猝死,其預後惡劣。臨床工作中必須即刻進行最有效的處理,終止尖端扭轉型室速的發作。TDP的臨床治療較單形性室速更為複雜,治療原則為終止TDP的發作,祛除誘因和治療病因。
目前有著顯著的飛躍與發展。其治療措施包括藥物、起搏器、射頻導管消融(RFCA)及埋藏式心臟復律除顫器(ICD)等治療。而藥物治療一直是基本選擇,即使按裝了ICD,仍需抗心律失常藥物的有效控制。故根據個體化原則,依不同病因,選擇不同治療對策。
因先天性和獲得性兩類原因所致尖端扭轉型室速的發病機制有不同,治療也存在差別,分別敘述如下。
1、獲得性長Q-T間期綜合徵並尖端扭轉型室速
(1)糾正或解除病因。
(2)提高基礎心率:
①異丙腎上腺素:目前認為是治療本病的首選藥,機制是其能提高基本心搏的頻率,使心室復極一致,縮短Q-T間期。一般採用靜脈滴注,以0、06~0、1μg/(kg?min)(2~8μg/min)持續靜脈滴注,先小劑量後大劑量,使心室率在90~110次/min。
②阿托品:阿托品可提高心室率,一般採用靜脈注射每次0、03mg/kg,每半小時1次,對高度房室結傳導阻滯誘發的TDP者有效,對高度希氏阻滯者引發TDP者可使心房率增快並加重阻滯程度,進一步增加心動過速的危險性。對藥物引起TDP而與房室傳導阻滯無關的長Q-T間期綜合徵患者,其療效不一,許多病例無效。
(3)補鉀治療:體內鉀鎂離子與心肌復極密切相關,低鉀鎂可使心電圖上出現Q-T間期延長,U波明顯,此為誘發TDP的基礎。由於鉀離子主要在細胞內,機體缺鉀時血鉀濃度不一定過低,但可引起TDP,所以TDP發作時,不論有無低血鉀,均可補鉀治療,一般靜脈滴注0、3%氯化鉀,甚至可達0、5%,總量75~100mg/(kg?d)。
(4)補鎂治療:硫酸鎂治療TDP近年報導漸增多,認為是一種簡單、有效而安全的方法,Tzivoni報導3例扭轉型室性心動過速,其血清鉀、鎂均正常,用異丙腎上腺素、利多卡因等治療無效,用25%硫酸鎂8ml靜脈注射,TDP得到有效控制,廣東醫學院兒科1例TDP用異丙腎上腺素控制不完全,後與25%硫酸鎂0、2ml/kg靜脈滴注合用,逐漸控制TDP發作。用法:25%硫酸鎂,0、2ml/kg,濃度鈣離子天然拮抗藥,可能對早期後除極有抑制作用。
②補充體內鎂的缺乏。現已知,鎂是人體細胞內僅次於鉀離子即處於第2位的陽離子,與體內300多種酶活性有關,機體缺乏鎂時,可導致這些鎂,尤其是與ATP有關酶的功能不足。體內的鎂離子僅有1%存在於血液中,即使鎂缺乏,血鎂濃度仍可在正常水平。但可引起明顯的病理生理作用。如細胞膜的鈉鉀ATP酶功能不足,使鉀離子不能進入細胞內,鈉離子不能釋放出細胞外,從而誘發TDP的發生。
③鎂離子可抑制交感神經節,減低心肌應激性,對消除異位心律有作用。成人一般以25%硫酸鎂10ml緩慢靜脈注射後,再用0、5%~1%硫酸鎂溶液250~500ml靜脈滴注,維持5~7天。
④靜脈滴注鎂劑可引起血壓降低,故在使用前應評估心功能和血壓狀況。
(5)利多卡因:利多卡因是室性心動過速的首選藥,但對TDP的療效評價不一,張乾忠報導用利多卡因靜脈滴注(5%葡萄糖液利多卡因200mg,8~10滴/min),治療2例長Q-T間期伴TDP有效。段氏報導3例利多卡因治療有效,並認為,一般劑量對心肌傳導、收縮及血流動力學方面均無不良影響,且對浦肯野纖維和心室肌交界處的傳導有一定改善,從而消除雙向或單向傳導阻滯,有利於終止折返,故可用於TDP。但需注意,利多卡因對缺血心肌有延長復極作用,對房室傳導阻滯、病態竇房結綜合徵以及基礎心率緩慢者不宜使用。
(6)維拉帕米:TDP發作在使用其他藥物治療無效時,可使用維拉帕米,但不宜作第一線藥物。Grenadier對4例多種治療無效的TDP患者使用維拉帕米3例終止,且未反覆。維拉帕米治療TDP機制不清,可能包括兩方面:
①抑制心肌細胞膜鈣離子內流而抑制早期後除極的發生;
②非競爭性地降低交感神經和增加迷走神經張力的作用,使用劑量0、1~0、2mg/kg,稀釋後緩慢靜脈注射,一次量不超過5mg。
(7)直流電擊復律:直流電擊復律用於TDP尚有爭議。一種認為電復律會損傷心肌使病情惡化;另一種認為低能量的直流電電擊對心肌並無明顯損傷,故應適時採用直流電復律術,以免轉為心室顫動後導致更為嚴重的心肌損傷改變。國內段氏報導8例TDP,用100~300J電復律26次,17次取得成功,9次失敗(2例電擊後心臟驟停,1例轉為室顫而死亡,6次電擊後仍為TDP)。但需要注意,在低血鉀、嚴重心臟傳導阻滯、藥物中毒情況下慎用。
2、先天性長Q-T間期綜合徵並尖端扭轉型室速
(1)避免劇烈運動。
(2)交感神經類藥物和腎上腺素類藥物:避免使用交感神經類藥物和腎上腺素類藥物,但有作者認為先天性者同時存在心動過緩依賴和腎上腺素依賴,並有報導套用異丙腎上腺素有效,但需慎用。
(3)β受體阻滯藥:為首選藥物,普萘洛爾0、05~0、15mg/kg,稀釋後緩慢靜脈注射,一次量不超過3mg。
(4)苯妥英鈉:使Q-T間期縮短,對控制尖端扭轉型室速可能有效。
(5)起搏器或手術:對頑固性發作者,安裝起搏器或手術治療。對於藥物治療無效可作左側交感神經節切除。反覆發作暈厥易致心臟性猝死,可用埋藏式心臟自動復律除顫器。經確診為LQTS即便無症狀也應長期服用普萘洛爾(心得安),2mg/(kg?d),分3次,必要時可增大至3~4mg/kg,可減少暈厥發作及心臟性猝死,平時避免情緒激動,體力勞動,以防引發暈厥,導致心臟性猝死。禁忌用兒茶酚胺類及IA、IC及Ⅲ類抗心律失常藥。
(二)預後
TDP不會連續發作,發作若干次後,可停止,隔一斷時間又發作。未經治療的有症狀患者,首次暈厥發作後第1年的病死率大於20%,10年內病死率高達50%。近年,以β受體阻滯藥藥物為主,輔以心臟起搏及左側心交感神經節切除術治療,已使5年病死率降至3%~4%。LQTS是由於離子通道不同、遺傳基因異常所致。以分子遺傳學手段了解LQTS產生的不同機制,從而為建立完善治療策略開闢新的途徑。基因治療無疑對LQTS治療展示良好的發展前景。此外,根據目前對LQTS亞型的研究,有助於考慮新的治療對策。但LQTS的根治,將有賴於基因治療。