術語解釋
不同物質如果具有相同的對比壓(壓力與臨界壓力之比)和對比溫度(溫度與臨界溫度之比),就是處於對應態,這時它們的各種物理性質都具有簡單的對應關係。
自然界中的各種物質都存在臨界狀態,此時其液態的比體積與氣態比體積相同。臨界狀態的狀態參數稱臨界參數,如臨界壓力、臨界比體積、臨界溫度,分別用p、v、T表示。假如用壓力、比體積和溫度與臨界壓力、臨界比體積、臨界溫度的比值來衡量工質的壓力、比體積、溫度,並令
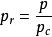 對比壓力
對比壓力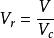 對比壓力
對比壓力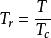 對比壓力
對比壓力式中p、v、T分別稱為對比壓力、對比比體積、對比溫度。這些量稱對比參數,它們都是無量綱量,它表明物質所處的狀態離開其本身臨界狀態遠近的程度。如果兩種或幾種物質的狀態具有相同的對比參數,表明它們離開其各自的臨界狀態的程度相同,則稱這些物質處於對應狀態。在臨界狀態,任何物質的對比參數都相同,且都等於1。
性質
(1)對比壓力是無量綱量,因為對比參數都是無量綱量,它表明物質所處的狀態離開其本身臨界狀態遠近的程度。如果兩種或幾種物質的狀態具有相同的對比參數,表明它們離開其各自的臨界狀態的程度相同,則稱這些物質處於對應狀態。
(2)在臨界狀態,任何物質的對比參數都相同,且都等於1。
(3)用對比參數表示的狀態方程式稱為對應態方程。它的特點是式中不包含反映個別物質特性的常數,它的一般式可寫成:
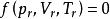 對比壓力
對比壓力具體的對應態方程,具有不同的形式。對於能滿足同一對應態方程式的同類物質,如果它們的對比參數p、v、T中有兩個相同,則第三個對比參數就一定相同,物質也就處於對應狀態中。以上的結論稱為對應態定律。服從對應態定律,並能滿足同一對應態方程的一類物質稱為熱力學上相似的物質。
(4)套用對應態定律可以對實際氣體熱力性質進行近似計算。
對應態原理是一種特別的狀態方程,也是預測流體性質最有效的方法之一。為了拓寬對應態原理的套用範圍和提高計算精度,研究者引入第三參數而建立的普遍化關係式。
分類
絕對壓力
直接作用於容器或物體表面的壓力,稱為“絕對壓力”,絕對壓力值以絕對真空作為起點,符號為PABS(ABS為下標)。
臨界壓力
物質處於臨界狀態時的壓力(壓強)叫臨界壓力。就是在臨界溫度時使氣體液化所需要的最小壓力。也就是液體在臨界溫度時的飽和蒸氣壓。在臨界溫度和臨界壓力下,物質的摩爾體積稱為臨界摩爾體積。臨界溫度和臨界壓力下的狀態稱為臨界狀態。
原理
以Zc作為第三參數的對應態原理
LydersenL等以Zc作為第三參數,將壓縮因子表示為
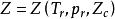 對比壓力
對比壓力即認為Zc相等的真實氣體,如果兩個對比參數相等,則第三個對比參數必相等。他們根據包括烴、醇、醚、酯、硫醇、有機鹵化物、部分無機物和水在內的82種不同物質的p-V-T性質和臨界性質數據,按Zc將所選物質分為0.23,0.25,0.27,0.29四組,分別得到了各組的Z和其他對比熱力學性質與Tr和pr的數據圖,不僅可用於氣相,還可用於液相。
以ω作為第三參數的對應態原理
除了以Zc作為第三參數外,還可以採用其他表示分子結構特性的參數作為第三參數,如Pitzer提出的偏心因子ω獲得了廣泛套用。
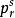 對比壓力
對比壓力純態物質的偏心因子是根據物質的蒸氣壓定義的。實驗發現,純態流體對比飽和蒸氣壓的對數與對比溫度Tr的倒數近似於直線關係,即滿足
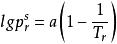 對比壓力
對比壓力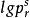 對比壓力
對比壓力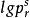 對比壓力
對比壓力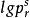 對比壓力
對比壓力實驗結果表明,不同的流體a的數值不同。但Pitzer發現,當將對1/Tr作圖時,簡單流體(氬、氪、氙)的所有蒸氣壓數據都集中在同一直線上,而且該直線還通過Tr=0.7,=-1這一點。然而其他流體(除H2、He外)在Tr=0.7時則有<-1。考慮到一般流體與簡單流體對比蒸氣壓的差別,提出了偏心因子ω的概念
 對比壓力
對比壓力因此,任何流體的ω均可由該流體的臨界溫度Tc,pc以及Tr=0.7時的飽和蒸氣壓數據來確定。
根據ω的定義,氬、氪、氙這類簡單流體的ω=0,而其他流體ω>0(除H2、He外)。偏心因子ω表征了一般流體與簡單流體分子間相互作用的差異。
Pitzer提出的三參數對應態原理可以表述為:對於所有ω相同的流體,若處在相同的Tr和pr下,其壓縮因子Z必定相等。壓縮因子Z的關係式為
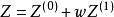 對比壓力
對比壓力式中,Z 和Z 都是T和p的函式,而偏心因子ω是第三參數。
對於非極性或弱極性的氣體,Pitzer普遍化關係式能夠提供可靠的結果,誤差小於3%;對強極性氣體則誤差達5%~10%;而對於締合氣體和量子氣體,誤差較大。
Lee和Kesler推廣lPitzer提出的關聯方法,並提出了三參數對應態原理的解析表達式:
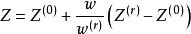 對比壓力
對比壓力式中,Z 和Z 分別為簡單流體和參考流體的壓縮因子,ω =0.3978,該方程簡稱為L-K方程。L-K方程中,Z 和Z 都可用修正的BWR方程求得。簡單流體的方程常數由Ar、Kr和CH4的實驗數據擬合得到,參考流體的方程常數由正辛烷實驗數據得到。
可以預測,在L-K方程中,研究流體與參考流體的性質越接近,預測結果的準確性和可靠性就越高。因此採用兩個非球形參考流體有可能使研究流體與參考流體的性質儘可能接近。
