簡介
多型性轉變(allotropic transformation)又稱同素異構轉變、同素異晶轉變或同位異構轉變。指一種元素或化合物隨溫度和壓力的不同而發生的結構類型轉變。當發生多型性轉變時,由於不同晶體結構的緻密度和配位數等不同,將伴隨有體積變化和電阻、熱膨脹係數等物理參量的突變。多型性轉變所對應的溫度點稱為臨界點。與液體結晶相類似,新的結構類型的形成也是以形核和長大的方式進行。
固態中的多型性轉變具有較大的過冷傾向。最常見的是鐵的多型性轉變。在912℃由α-Fe(bcc)轉變為γ-Fe(fcc),而在1394℃則由γ-Fe轉變為δ-Fe(bcc)。除鐵外,如Mn、Ti、Sn、C、Ca、Ce、Pr等也具有多型性轉變的特徵。另外,一些化合物如SiO、BN、TiO、NaBaNbO(BNN)等也具有該特徵。通常,具有同素異構特性的元素,在低溫態大多具有密排結構(hcp或fcc),而在高溫態則大多具有bcc結構,只有少數情況例外,如Sn等。固態下元素所表現的多型性,主要與該類原子的電子層結構的變化有關。即在不同溫度或壓力下,通過參與鍵合的外層電子分布狀態的改變,而引起原子間結合能以致點陣形式發生改變。多型性轉變是金屬材料熱處理的依據之一。
熱力學條件及機理
(一)多型性的金屬或合金,若具有兩種晶體結構,則它們在不同溫度下的自由能曲線,如圖所示。
從圖中可以看出,當溫度低於T時,α相的自由能F低於β相的自由能F,此時α相是穩定的。因此β相要向α相轉變,即β→α。當溫度高於T時,β相的自由能F小於F,β相是穩定的。因此α相有可能向β相轉變,即α→β。當溫度正好為T時,F=F,α和β兩相處於平衡,即α←→β。T是標誌著一個相態轉變為另一個相態的溫度,因此稱它為相變溫度(或轉變溫度),又叫作臨界點。
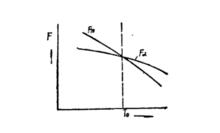 不同晶體結構的自由能與溫度的關係
不同晶體結構的自由能與溫度的關係β→α或α→β的多型性轉變,正如金屬的結晶一樣,也是通過形核和核長大的步驟來進行的。新相的核心主要產生在母相的晶界上。這是因為晶界層原子排列較亂,結構比較疏鬆,便於原子的重新排列。同時,晶界層的原子具有較高的自由能,為形成新的相界面提供了必須的條件。
不僅舊相晶界對新相的形核起很大作用,高熔點的雜質質點也能起相似的作用。
新相晶核形成後,其長大則根據過冷度的大小不同,可能沿兩種途徑進行。當過冷度較小時,長大是靠原子從舊相擴散轉移來進行的。這種擴散轉移所需的激活能很大,溫度不高時,相界面上只有一部分原子能借熱振動獲得這種為轉移所必須的能量起伏。因此靠這種情況來進行轉變,速度是非常緩慢的,這就叫作擴散型的轉變。當過冷度很大時,在某些金屬和合金中,晶核是共格式的長大,原子的移位及其激活能都很小,因此晶格的改組或重新排列的過程,甚至可以在極低的溫度下也能很快進行,因此稱這種轉變為共格型轉變。
(二)多型性金屬具有三種或更多種晶體結構時,則轉變較為複雜。下圖表示金屬或合金的三種不同晶體結構(α、β、γ)自由能與溫度的關係曲線。
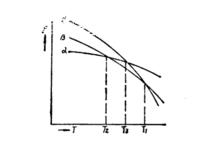 三種晶體結構的自由能與溫度的關係
三種晶體結構的自由能與溫度的關係圖的T、T各相當於β和γ、α和β的平衡溫度或轉變溫度。在T以上,γ相的自由能F最低,因此γ相是熱力學穩定的。若使溫度過冷到T與T的溫度之間,在熱力學上僅能生成β晶體,直至γ相完全轉變為β相才結束。T溫度以下,α相的自由能F最低,最穩定,β相就要轉變為α相。假若原γ相,過冷到T溫度以下,則由於α和β相在此溫度時均較γ相具有較低的自由能,因此α及β兩個低溫相都有可能析出。在T與T溫度之間,γ→β的轉變,較之γ→α會引起自由能更大的降低。因此從熱力學上看,γ→β的轉變應該進行。但是,由於γ→α的轉變可能在動力學上比較有利(α和γ的晶格類型有較大的相似性),因此α相形核的幾率和生長速度可能要高於β相。在這樣的過冷度情況下,α和β二相同時形核和長大也是可能的。
若快速冷卻,γ相也能過冷到T溫度以下,此時在γ相中,α及β相都可能形核和長大。生成的α和β相的數量決定於它們形核,長大的動力學條件(成分起伏、結構起伏等)。
在所有這些情況下,轉變可以通過原子的擴散來實現,也可以通過共格型或切變型來實現。生成的組織可以是單相的、兩相的或三相的。而各相的狀態可以是穩定的,或者是亞穩定的。
同素異構和多型性轉變
很多材料在特定溫度和壓力下會發生晶體結構的轉變,元素的這種行為稱為同素異構轉變。化合物的這種行為稱為多型性轉變。如純鐵在912℃以下是具有BCC結構的α-Fe,在912~1394℃之間則變為FCC結構的γ-Fe,而在1394℃~熔點(1540℃)之間又變為BCC結構的δ-Fe。α-Fe、γ-Fe、δ-Fe都是鐵的同素異構體。
另一個同素異構體材料是碳。如下圖所示,它可以以金剛石或石墨的晶態存在。金剛石具有配位數(CN)等於4的共價鍵四面體三維網路結構。三維共價網路中異常高的鍵合強度,使得金剛石的熔點和硬度比任何其他元素的都高。相反,碳在室溫下熱力學有利的形式是石墨,它具有六邊形二維層狀結構。在這種結構中層面上的碳原子僅有3個最近鄰,其間構成共價鍵;但層與層之間是結合力比較弱的二次鍵,二次鍵比較容易斷開使得石墨具有優越的潤滑性。
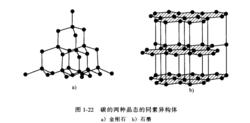 碳的兩種晶態的同素異構體
碳的兩種晶態的同素異構體近年來,在碳的同素異構體中又不斷出現新的成員。下圖分別表示富勒烯、碳納米管和碳納米筒的結構。富勒烯是1985年發現的團簇狀新材料(克勞托等人因這一發現,得到了1996年的諾貝爾化學獎)。被稱為C的富勒烯是由60個碳原子組成,其結構類似於一個足球的球狀中空結構(直徑約為0.7nm)。碳納米管是與富勒烯結構非常相似、非球狀且沿一個方向延伸的針狀結晶。由於針狀結晶是中空的,因此稱為納米管。對其中塞滿微細針狀結晶的稱為納米導線。納米管和納米導線直徑約為1nm到數十納米,長度為幾微米大小。納米筒的形狀類似於盛冰淇淋的圓錐筒,其端部細而尖。此外,納米片、納米帶是厚度在幾納米的微細薄膜狀材料。
除Fe、C外,如Mn、Ti、Sn、Ca、Ce、Pr等也具有同素異構轉變的特徵。通常,具有同素異構特性的元素在低溫態大多具有密排結構(HCP或FCC),而在高溫態則大多具有BCC結構,只有少數情況例外,如Sn等。固態下元素所表現的同素異構性,主要與該類原子的電子層結構的變化有關。即在不同溫度或壓力下,通過參與鍵合的外層電子分布狀態的改變,而引起原子間結合能以致點陣形式發生改變。
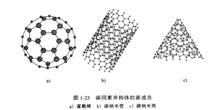 碳同素異構體的新成員
碳同素異構體的新成員當發生同素異構和多型性轉變時,由於不同晶體結構的緻密度和配位數等不同,將伴隨有體積變化和電阻、熱膨脹係數等物理參量的突變。同素異構和多型性轉變所對應的溫度點稱為臨界點。與液體結晶相類似,新的結構類型的形成也是以形核和長大的方式進行。固態中的多型性轉變具有較大的過冷傾向。
很多陶瓷材料,如二氧化矽(SiO)、氧化鋁(AlO)和氧化鈦(TiO)隨溫度改變會發生幾種晶體結構的改變,其性能伴隨結構改變而變化。例如,體積變化而引起密度可能增加或減少。很多陶瓷材料不能經受這種體積變化所產生的內應力,這些材料在轉變溫度下失效,如氧化鋯(ZrO)就是一個例子。正方系的氧化鋯(冷卻)在約1000℃時多型性轉變為單斜系氧化鋯,伴隨著體積變化可使材料斷裂。
同素異構和多型性轉變是金屬材料熱處理的依據之一,也是製備新材料、控制陶瓷材料性能必須要考慮的因素之一。
鐵的多型性轉變
在壓力變化的條件下,固態鐵可呈三種不同的晶體結構:
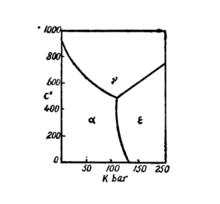 固態純鐵的相圖
固態純鐵的相圖1.體心立方晶格的鐵,α-Fe;
2.面心立方晶格的鐵,γ-Fe,
3.密排六角晶格的鐵,δ-Fe(如下圖)。
在常壓下,鐵只呈現兩種不同的晶體結構,即α-Fe和γ-Fe。
純金屬的多型性轉變(又叫同素異型轉變)只是一種有晶體結構的變化而無成分變化的相變。根據金屬的純度不同,舊相的晶粒大小以及冷卻速度的不同,鐵的多型性轉變可能以下面三種方式進行。
1.形核,長大的方式進行
在常壓和極緩慢的冷卻速度條件下,γ-Fe→α-Fe的轉變溫度接近910℃。在這種條件下,α-Fe通過擴散型的轉變方式(形核,長大都需要Fe原子作長距離的擴散)進行。
2.塊形轉變方式進行
若冷卻速度在5000~30000℃/s之間時,則γ-Fe→α-Fe以塊形轉變的方式進行。塊形轉變形成的α-Fe,如下圖所示。
 塊形轉變生成的α-Fe
塊形轉變生成的α-Fe塊形轉變時,γ-Fe與α-Fe的相界面不共格,但具有高的界面能,γ-Fe的原子僅跳動幾次便轉移到α-Fe,不需長距離的擴散,相界面的移動是非常迅速的。雖然如此,但仍然是通過形核、長大的步驟進行,只不過這兩個步驟不太明顯而已。
塊形轉變必須造成一定大的過冷度才能實現,鐵發生這種轉變是在750℃,過冷度約為170℃。因為只有在足夠的過冷度條件下,才能提供不共格介面的能量,同時,也只有這樣才能抑制住在此相變前不發生其它擴散型的相變。
3.馬氏體型或切變型方式進行
若冷卻速度再增加, 如達到40000~50000℃/s,γ-Fe以馬氏體型相變生成α-Fe,α-Fe呈針狀形態,表面發生了傾動或折縐。這種轉變所需要的冷卻速度與鐵的純度有關,純度越高,所需的過冷度越大,純度越低,則所需的過冷度越小。
