基本信息
主要用途:用於製造鈦鹽、虹彩劑、人造珍珠、煙幕、顏料、織物媒染劑等製備或來源:由二氧化鈦、碳粉和澱粉調和後,在600℃時通入氯氣而製得。毒性及安全:四氯化鈦有水解性,其危險也一般與生成的氯化氫有關。四氯化鈦也是強路易斯酸,會與路易斯鹼(甚至弱路易斯鹼)放熱反應形成加合物,與水則爆炸性反應。理化常數:國標編號 81051
CAS號 7550-45-0
中文名稱 :四氯化鈦
英文名稱 Titanium tetrachloride;Titanic chloride
別 名: 氯化鈦
分子式 TiCl4外觀與性狀 :無色或微黃色液體,有刺激性酸味。在空氣中發煙
分子量: 189.71蒸汽壓 :1.33kPa(21.3℃)
熔點: -25℃沸點:136.4℃溶解性:溶於冷水、乙醇、稀鹽酸
密度 :相對密度(水=1)1.73 穩定性 穩定
危險標記 20(酸性腐蝕品)
化學性質
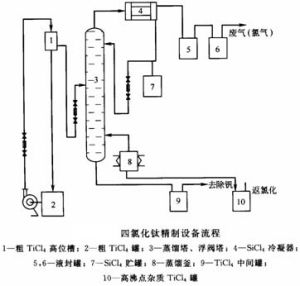 四氯化鈦生產流程
四氯化鈦生產流程 TiCl4可溶於非極性的甲苯和氯代烴中。研究表明溶解在某些芳香烴的過程中涉及類似於[(C6R6)TiCl3]+配合物的生成。四氯化鈦可與路易斯鹼溶劑(如THF)放熱反應,生成六配位的加合物。對於體積較大的配體,產物則是五配位的TiCl4L。除了釋放出腐蝕性的氯化氫之外,存放TiCl4時還會生成鈦氧化物及氯氧化物,粘住使用過的塞子和注射器。
物理性質
四氯化鈦是無色密度大的液體,樣品不純時常為黃或紅棕色液體。與四氯化釩類似,它屬於少數在室溫時為液態的過渡金屬氯化物之一,其熔沸點之低與弱的分子間作用力有關。大多數金屬氯化物都為聚合物,含有氯橋連線的金屬原子,而四氯化鈦分子間作用力卻主要為弱的范德華力,因此熔沸點不高。四氯化鈦,或氯化鈦(IV),是化學式為TiCl4的無機化合物。四氯化鈦是生產金屬鈦及其化合物的重要中間體。室溫下,四氯化鈦為無色液體,並在空氣中發煙,生成二氧化鈦固體和鹽酸液滴的混合物。性質及結構
 四氯化鈦
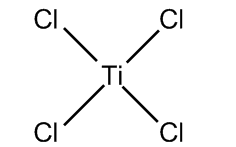
四氯化鈦 TiCl4分子為四面體結構,每個Ti4+與四個配體Cl−相連。Ti4+與稀有氣體氬具有相同的電子數,為閉殼層結構。因此四氯化鈦分子為正四面體結構,具有高度的對稱性。
TiCl4可溶於非極性的甲苯和氯代烴中。研究表明溶解在某些芳香烴的過程中涉及類似於[(C6R6)TiCl3]+配合物的生成。四氯化鈦可與路易斯鹼溶劑(如THF)放熱反應,生成六配位的加合物。對於體積較大的配體,產物則是五配位的TiCl4L。
除了釋放出腐蝕性的氯化氫之外,存放TiCl4時還會生成鈦氧化物及氯氧化物,粘住使用過的塞子和注射器。
生產
TiCl4可通過氯化法製備。具體過程是,900°C時用碳在氯氣氛中與鈦氧化物礦物(如鈦鐵礦和金紅石)反應,蒸餾純化產物。2FeTiO3+7Cl2+6C→2TiCl4+2FeCl3+6CO
TiCl4並不昂貴,通常用於實驗室用途。
套用
鈦金屬生產
TiO2+2Cl2+2C→TiCl4+2COKroll法的第一步是用金屬鎂還原TiCl4:
2Mg+TiCl4→2MgCl2(l)+Ti
液態鈉也可被用作還原劑:
4Na+TiCl4→4NaCl+Ti
二氧化鈦生產
大約90%的TiCl4都被用於製造鈦白顏料(TiO2),該過程主要是四氯化鈦的水解反應:TiCl4+2H2O→TiO2+4HCl
有時用純氧作氧化劑:
TiCl4+2O2→TiO2+2Cl2
煙霧劑
過去曾用四氯化鈦來製造煙幕。露置在空氣中時,四氯化鈦會迅速與空氣中的水反應:TiCl4+2H2O→TiO2+4HCl
生成的氯化氫會迅速吸收更多的水,生成細小的鹽酸液滴;而當空氣中的濕度更大時,更大的鹽酸液滴則會產生更好的散射效果。而且生成的白色二氧化鈦粉末也是很好的散射質。
由於鹽酸具有腐蝕性,現在已不再使用TiCl4作煙霧劑。
化學反應
有機金屬化學及無機化學
TiCl4與TiBr4和TiI4具有類似結構,而且它們的化學性質也很相像。例如TiCl4和TiBr4反應生成混合鹵化物TiCl4-xBrx(x=0,1,2,3,4)。核磁共振結果顯示,TiCl4和VCl4之間有相當迅速的鹵素交換。
TiCl4是很強的路易斯酸。其水解反應既體現了它電子接受體的特性,涉及中間體TiCl4(H2O)。四氯化鈦可與THF反應生成黃色的TiCl4(THF)2,繼續與Cl−反應則生成[Ti2Cl9]−、[Ti2Cl10]2−和[TiCl6]2−。有趣的是,TiCl4與氯離子的反應與相應的正離子有關,譬如四氯化鈦與NBu4Cl反應得到五配位的NBu4TiCl5,而與體積小的NEt4Cl反應則得到(NEt4)2Ti2Cl10。這些反應體現了靜電引力對離子性很強的化合物的影響。
有機鈦化學基本上都是以TiCl4作原料。其中比較重要的包括四氯化鈦與環戊二烯基鈉生成二氯化二環戊二烯基鈦(Titanocenedichloride,TiCl2(C5H5)2)的反應。產物又被稱為特伯試劑(二氯化二環戊二烯基鈦與三甲基鋁形成的配位化合物)。芳香烴類,如六甲基苯C6(CH3)6,與四氯化鈦反應生成夾心配合物[Ti(C6(CH3)6)Cl3]+,體現了用更強的路易斯酸試劑AlCl3與四氯化鈦反應衍生出的TiCl3+的強路易斯酸性。
TiCl4與四分子的LiNMe2反應生成黃色可溶於苯的液體Ti(NMe2)4,該分子為四面體構型,中心氮為平面結構。
有機合成試劑
有機合成中常用四氯化鈦作路易斯酸。在Mukaiyama羥醛反應中涉及了TiCl4與電子給予體(醛)的反應(生成類似於(RCHO)TiCl4OC(H)R的加合物)。
在McMurry反應中使用鋅、四氯化鈦和氫化鋁鋰(或其它還原劑)作催化劑,完成醛或酮的還原二聚生成烯烴。
烯烴聚合反應
四氯化鈦及其許多衍生物都可作為製取齊格勒-納塔催化劑的前體。機理可能是:還原
還原TiCl4得到TiCl3。用鋁在THF中還原TiCl4,產物是淡藍色的四氫呋喃加合物TiCl3(THF)3。
對環境的影響
1、健康危害侵入途徑:吸入、食入。
健康危害:皮膚直接接觸液態四氯化鈦可引起不同程度的灼傷。其煙塵對呼吸道黏膜有強烈刺激作用。輕度中毒有喘息性支氣管炎,嚴重者出現呼吸困難、呼吸脈搏加快、體溫升高、咳嗽等,可發展成肺水腫。
2、毒理學資料及環境行為
毒性:屬高毒類。
急性毒性:LC50400mg/m3(大鼠吸入)
危險特性:受熱或遇水分解放熱,放出有毒的腐蝕性煙氣。
燃燒(分解)產物:氯化物、氧化鈦。
3.實驗室監測方法
滴定法(EPA方法9252)氣相色譜法,參照《分析化學手冊》(第四分冊,色譜分析),化學工業出版社
4.環境標準
前蘇聯車間空氣中有害物質的最高容許濃度1mg/m3應急處理處置方法
1、泄漏應急處理疏散泄漏污染區人員至安全區,禁止無關人員進入污染區,建議應急處理人員戴正壓自給式呼吸器,穿化學防護服。不要直接接觸泄漏物,在確保全全情況下堵漏。噴水霧減慢揮發(或擴散),但不要對泄漏物或泄漏點直接噴水。將地面灑上蘇打灰,然後用大量水沖洗,經稀釋的洗水放入廢水系統。如果大量泄漏,最好不用水處理,在技術人員指導下清除。
2、防護措施
呼吸系統防護:可能接觸其蒸氣時,應該佩帶防毒口罩。必要時佩帶防毒面具。
眼睛防護:戴化學安全防護眼鏡。
防護服:穿工作服(防腐材料製作)。
手防護:戴橡皮手套。
其它:工作後,淋浴更衣。單獨存放被毒物污染的衣服,洗後再用。保持良好的衛生習慣。
3、急救措施
皮膚接觸:儘快用軟紙或棉花等擦去毒物,然後用水徹底沖洗。若有灼傷,就醫治療。
眼睛接觸:立即提起眼瞼,用流動清水沖洗10分鐘或用2%碳酸氫鈉溶液沖洗。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。呼吸困難時給輸氧。給予2-4%碳酸氫鈉溶液霧化吸入。就醫。
食入:患者清醒時立即漱口,給飲牛奶或蛋清。立即就醫。
滅火方法:乾粉、砂土。禁止用水。物質的理化常數。