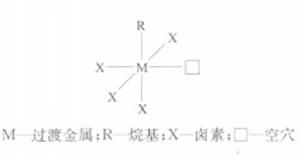
簡介
由Cossee等提出的單金屬機理是基於以下實驗事實:Beerman和Bestian發現TiCI或TiCl很容易被AI(CH)烷基化。控制Al/Ti物質的量之比,可以得到各種產物,並對所得的產物CHTiCl或(CH)TiCl進行了表征。
TiCl +AI(CH)→CHTiCl+AI(CHl)CI
對於CrO-SiO和MoO-AlO體系,無需烷基金屬活化即可引發乙烯聚合,且具有很高的催化活性。這是單金屬機理最有意義的證據。
單金屬機理的觀點是催化活性中心為Ti-R的中間體,烷基鋁的作用是使TiCI或TiCl烷基化。
丙烯聚合機理
丙烯聚合反應的機理相當複雜。一般來說,分為四個基本反應步驟,即活化反應、形成活性中心、鏈引發、鏈增長及鏈終止。
對於活性中心,主要有兩種理論:單金屬活性中心模型理論和雙金屬活性中心模型理論。普遍接受的是單金屬活性中心理論。該理論認為活性中心呈八面體配位並存在一個空位的過渡金屬原子。以TiCl為例,首先單體與過渡金屬配位,形成Ti配合物,減弱了Ti-C鍵,然後單體插入過渡金屬和碳原子之間。隨後空位與增長鏈交換位置,下一個單體又在空位上繼續插入。如此反覆進行,丙烯分子上的甲基就依次照一定方向在主鏈上有規則地排列,即發生陰離子配位定向聚合,形成等規或間規PP。對於等規PP來說,每個單體單元等規插入的立構化學是由催化劑中心的構型控制的,間規單體插入的立構化學則是由鏈終端控制的。
單金屬機理解釋
單金屬機理中定向吸附在TiCl表面的丙烯在空位處與Ti 配位(或稱π-絡合),形成四元環過渡狀態,然後R基和單體發生順式加成(重排),結果使單體在Ti-C間插入增長,同時空位重現,但位置改變。如果按這樣再增長,將得到間同聚合物。空位“飛回’’到原來位置上,才能繼續增長成全同聚合物。
當單體在Ti的空位上配位後,單體雙鍵的π電子的給電子作用使Ti-C鍵活化。Ti -Ti 極化後,通過碳陰離子σ電子和雙鍵π電子的轉移,完成單體的插入反應,定向全過程如下圖所示。
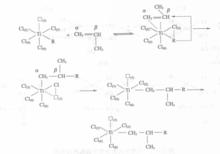 單金屬機理
單金屬機理單體在Ti上配位,隨後在Ti-C鍵間插入,這就是配位陰離子聚合單金屬機理。Zie-glerNatta定向聚合的兩個顯著特徵是每步增長都是R基連在單體的β碳原子上,是順式加成。
用Ⅰ~Ⅲ族金屬有機化合物單一組分,未能製得全同聚丙烯。但單用鈦組分製得全同聚合物卻有不少例子。加上其他一些數據,使Cosser-Arlman單金屬機理更推進了一步,被更多人所接受。但是,Ⅰ~Ⅲ族金屬有機物共引發劑對α-烯烴配位聚合的定向能力和引發活性都有很大的提高,單金屬機理還不能解釋,也曾提出雙金屬絡合和空位的修正模型。