成份
 力如太
力如太本品主要成份為利魯唑
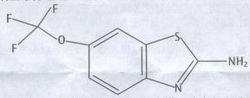
化學名稱:2-氨基-6-三氟甲氧基苯並噻唑
化學結構式:
分子式:CHFNOS
分子量:234.20
性狀
本品為白色異形薄膜衣片,一側刻有“RPR 202”字樣,除去包衣後顯類白色。
適應症
利魯唑適用於延長肌萎縮側索硬化(ALS)患者的生命或延長其發展至需要機械通氣支持的時間。
臨床試驗已經證明利魯唑可延長ALS患者的存活期。存活的定義為不需插管進行機械通氣也未接受氣管切開的存活患者。
沒有證據表明利魯唑對運動功能、肺功能、肌束震顫、肌力和運動症狀具有治療作用。在晚期ALS患者中利魯唑未顯示出療效。
僅在ALS中研究了利魯唑的安全性和有效性。因此,利魯唑不得用於任何其他類型的運動神經元病。
規格
50mg
用法用量
推薦劑量為每次1片,每日兩次(50mg每12小時一次)。
每日定時口服,如早晚各一片。
如漏服一次,按原計畫服用下一片。
增加每日劑量並不能顯著提高預期益處。
具有運動神經元病治療經驗的專科醫師才可啟用利魯唑治療。
不良反應
在利魯唑用於ALS患者的Ⅲ期臨床研究中,最常見報告的不良反應為乏力、噁心和肝功能檢測異常。
不良反應按照其發生率排序列出如下,使用如下約定:非常常見(≥1/10),常見(≥1/100至<1/10),不常見(≥1/1,000至 <1/100),罕見(≥1/10,000至<1/1,000),非常罕見(<1/10,000),未知(不能從已知數據評估)。
血液和淋巴系統異常不常見:貧血
未知:嚴重中性粒細胞減少症(見【注意事項】)
免疫系統異常不常見:類過敏反應、血管性水腫
神經系統異常常見:頭疼、眩暈、感覺異常、嗜睡
呼吸、胸部和縱隔疾病不常見:間質性肺病(見【注意事項】)
心臟異常常見:心動過速
胃腸道異常非常常見:噁心
常見:腹瀉、腹痛、嘔吐
不常見:胰腺炎
肝膽-異常非常常見:肝功能檢測異常。丙氨酸氨基轉移酶的增高通常發生於利魯唑治療的前3個月內 ;其通常為一過性.且當治療繼續時,其水平在2至6個月內恢復至低於正常上限2倍。這些増 高可伴有黃疸。在臨床試驗中ALT升高超過正常範圍上限5倍的患者中止治療後ALT水平在2~ 4個月內恢復至正常範圍上限2倍以下。(見【注意事項】)
未知:肝炎
一般性異常及綸藥部位狀況非常常見:乏力
常見:疼痛
禁忌
-對本品及其任何成份過敏。
-肝臟疾病或基線轉氨酶高於正常上限3倍者。
-妊娠及哺乳期。
注意事項
肝損害:
利魯唑慎用於有肝功能異常史的患者,或血清轉氨酶(ALT/SGPT; AST/SG0T升至正常上限3倍)、膽紅棄和/或γ-谷氨醯轉移酶(GGT)水平輕度增高的患者。肝功能檢測的基線堆高(特別是膽紅素升高)須禁止利魯唑的使用(見【不良反應】)。
因為有肝炎的風險,在利魯唑治療前和治療過程中應該進行血清轉氨酶,包括ALT的檢測。在治療最初3個月,須每月檢測ALT,在第1年每3個月檢測1次,以後每年一次。在發生ALT水平增高的患者,須進行更為頻繁的ALT水平的檢測。
如果ALT水平堆加至5倍ULN,利魯唑須停藥。在發生ALT増加至5倍ULN的患者尚無減量或再次給藥的經驗。不推薦利魯唑在這種情況患者的再次給藥。
中性粒細胞減少症:
須警告患者向其醫生報告所有的發熱疾病。發熱疾病的報告須提醒醫生檢查白細胞計數,在中性粒細胞減少情況下停止利魯唑的使用(見【不良反應】)。
間質性肺病
已有接受利魯唑治療報告間質性肺病的病例,其中一部分病例為嚴重病例(見【不良反應】)。如果出現呼吸症狀,例如乾咳和/或呼吸困難,應進行胸部X線檢查,如果有提示間質性肺炎的發現(例如兩側肺彌散不透明),應立即停用利魯唑。在大部分報告的病例中,停藥和對症治療後,症狀消除。
腎損害:
在中度或重度慢性腎功能不全(肌酐清除率在10-50ml/min)的患者和健康志願者單次口服50mg利魯唑給藥後,其藥代動力學參數無顯著差異。本品不推薦用於腎功能損害的患者,因為在此人群尚未進行重複給藥的研究。
對駕車和使用機器能力的影響
須警告患者有頭暈或眩暈的可能,並建議其當發生這些症狀時不要駕車或操作機器。
尚無對駕車和使用機器影響的研究。
孕婦及哺乳期婦女用藥
如果在妊娠期或懷疑妊娠,不可使用本品。
服用本品期間不可餵乳。
如果認為自己已懷孕,或準備懷孕,或須母乳隈養,請諮詢醫師。
兒童用藥
在兒童中不推薦使用本品,因為利魯唑套用於兒童或青少年中的有關神經變性作用的有效性及安全性尚未確立。
老年用藥
根據藥代動力學資料,對老年人用本品沒有特殊說明。
藥物相互作用
尚無臨床研究以評估利魯唑與其他藥品的互動作用。
使用人肝臟微粒體製劑的體外研究提示CYP1A2為參與利魯唑初始氧化代謝的主要同工酶。CYP1A2的抑制劑(如咖啡因,雙氮芬酸,地西泮,尼麥角林,氣米帕明,丙咪嗪,氟伏沙明,非那西汀,茶鹼,阿米替林以及喹諾酮類)可潛在降低利魯唑的清除率,而CYP 1A2的誘導劑(如捲菸煙氣,炭烤的食物,利福平以及奧美拉唑)可增加利魯唑的清除率。
藥物過量
在孤立病例曾觀察到神經和精神症狀,急性中毒性腦病伴木僵、昏迷,以及高鐵血紅蛋白血症。
在過量病例,行對症和支持治療。
採用亞甲藍治療後可迅速逆轉重度高鐵血紅蛋白血症。
藥理毒理
肌萎縮側索硬化症(ALS)的發病機理尚未完全闡明,有學說認為谷氛酸在此疾病中是造成細胞死亡的原因之一。 利魯唑的作用機制尚不清楚,其作用可能與抑制谷氨酸釋放、穩定電壓依賴性鈉通道的失活狀態、干擾神經遞質與興奮性胺基酸受體結合後細胞內事件有關。一項動物實驗顯示,利魯唑能延長ALS轉基因動物模型的存活時間。多種神經興奮性損傷動物模型研究顯示利魯唑具有神經保護作用。體外研究顯示,利魯唑能保護培養的大鼠運動神經元免受谷氨酸的興奮性毒性損傷,並抑制缺氧引起的皮層細胞死亡。
毒理研究:
遺傳毒性
利魯唑Ames試驗、L5178Y細胞基因突變試驗、大鼠細胞遺傳學試驗、小鼠微核試驗結果均為陰性;人淋巴細胞染色體畸變試驗結果意義不明確,第二次試驗未能重複該結果。
利魯唑主要活性代謝產物N-輕基利魯唑小鼠淋巴瘤試驗和體外L5178Y細胞微核試驗結果陽性,L5178Y細胞HPRT基因突變試驗、Ames試驗、大鼠肝細胞UDS試驗、人淋巴細胞染色體畸變試驗、小鼠微核試驗結果均為陰性。
生殖毒性
雄性和雌性大鼠經口給予利魯挫15mg/kg(按mg/m2推算,約相當於人日最大給藥劑量的1.5倍),未見對生育力的影響。大鼠和家兔致畸敏感期分別經口給予利魯唑27mg/kg和60mg/kg(按mg/m2推算,分別約相當於人日最大給藥劑量的2.6和11.5倍),可見母體毒性。雄性和雌性大鼠自交配前至圍產期經口給予利魯挫15mg/kg(按mg/m2推算,約相當於人日最大給藥劑量的1.5倍),可見著床率降低、胚胎死亡增加,幼仔存活力降低,生長減慢。
致癌性
小鼠和大鼠分別經口給予利魯唑20mg/kg和10mg/kg(按mg/m2推算,約相當於人日最大給藥劑置)連續2年, 未見致癌性。
藥代動力學
在健康男性志願者中,通過單一劑量口服25至300 mg以及每日兩次重複口服25至100mg對利魯唑的藥代動力學進行評估。其血藥濃度水平的升高與劑量呈線性關係,其藥代動力學特性是非劑量依賴性的。
重複劑量給藥時(50 mg利魯唑片,每日兩次,十天療程),利魯唑原形在血漿中蓄積至單一劑量的2倍,並於5日內達到穩態期。
吸收:利魯唑口服後吸收迅速,並於60至90分鐘內達最大血漿濃度(Cmax=173±72(sd)ng/ml)。大約劑量的90%被吸收,絕對生物利用度為60±18%。
在高脂飲食的同時服用利魯唑,其吸收率及吸收程度下降。(Cmax降低44%,曲線下面積降低17%)。
分布:利魯唑在體內分布廣泛,可通過血腦屏障。利魯唑的分布容積大約為245±69升(3.4升/公斤體重)。
利魯唑的蛋白結合率大約為97%,主要與血漿白蛋白及脂蛋白結合。
代謝:利魯唑主要以原形存在於血漿中,並由細胞色素P450廣泛代謝繼而糖脂化。在體外試驗中利用預備的人體肝臟顯示細胞色素P450 1A2為主要的利魯唑代謝有關的同功酶。在尿中的代謝產物為3種酚衍生物,1種脲基衍生物及原形利魯唑。
已鑑別和非結合的代謝產物在動物中不顯示利魯唑的藥效特性,因此在人體中未做研究。
排泄:排泄半衰期範圍在9至15小時。利魯唑主要從尿液中排出。
尿中總排泄率為劑量的90%。葡萄糖醛酸衍生物占尿中代謝產物的85%以上。僅有劑量2%的利魯唑以原形存在於尿中。
特殊人群
老年人:在老年人(>70歲)中利魯唑多次口服給藥(50毫克利魯唑每天兩次治療4.5天)的藥代動力學參數不受影響。
肝損傷:利魯唑50毫克單次口服給藥後,在輕度慢性肝功能不全的患者中,AUC大約升高1.7倍,在中度慢性肝功能不全的患者中,大約升高3倍。
腎損傷:在中度或重度慢性腎功能不全(肌酐清除率在10和50毫升/分鐘之間)的患者和健康志願者中利魯唑50毫克單次口服給藥後,藥代動力學參數沒有明顯的差異。
人種:在健康的日本和高加索成年男性中進行了一項臨床研究,每天兩次給藥8天后,評價利魯唑及其代謝產物 N-羥基利魯唑的藥代動力學。在日本和高加索受試者中,沒有發現利魯唑及其代謝產物的藥代動力學參數有人種間的差異。
貯藏
室溫(10-30°C)保存。
包裝
鋁塑泡罩包裝,56片/盒,14片/盒
有效期
36個月
執行標準
進口藥品註冊標準:JX20090316
批准文號
進口藥品註冊證號:小包裝:H20100080;大包裝:H20100640
進口分裝批准文號:國藥準字J20100164
生產企業
Aventis Pharma(Nenagh)Limited
核准日期
2010年12月10日
修訂日期
2010年12月24日