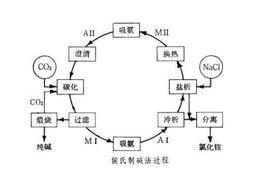
聯合制鹼法
聯合制鹼法又稱侯氏制鹼法
NH3+CO2+H20+NaCl=NH4Cl+NaHCO3↓ (NaHCO3 因溶解度較小,故為沉澱,使反應得以進行)
2NaHCO3=Na2CO3+CO2↑+H2O ("="上應有加熱的符號)
要點
是在索爾維制鹼法的濾液中加入食鹽固體,並在30 ℃~40 ℃下往濾液中通入氨氣和二氧化碳氣,使它達到飽和,然後冷卻到10℃以下,根據 NH4Cl 在常溫時的溶解度比 NaCl 大,而在低溫下卻比 NaCl 溶解度小的原理,結晶出氯化銨(一種化肥),其母液又可重新作為索爾維制鹼法的制鹼原料。
優點
保留了氨鹼法的優點,消除了它的缺點,使食鹽的利用率提高到 96 %; NH4Cl 可做氮肥;可與合成氨廠聯合,使合成氨的原料氣 CO 轉化成 CO2 ,革除了 CaCO3 制 CO2 這一工序。
碳酸鈉用途非常廣泛。雖然人們曾先後從鹽鹼地和鹽湖中獲得碳酸鈉,但仍不能滿足工業生產的需要。
1862年,比利時人索爾維(Ernest Solvay 1838—1922)發明了以食鹽、氨、二氧化碳為原料製取碳酸鈉的“索爾維制鹼法”(又稱氨鹼法)。此後,英、法、德、美等國相繼建立了大規模生產純鹼的工廠,並組織了索爾維公會,對會員以外的國家實行技術封鎖。
第一次世界大戰期間,歐亞交通梗塞。由於我國所需純鹼都是從英國進口的,一時間,純鹼非常缺乏,一些以純鹼為原料的民族工業難以生存。1917年,愛國實業家范旭東在天津塘沽創辦了永利鹼業公司,決心打破洋人的壟斷,生產出中國的純鹼。他聘請正在美國留學的侯德榜先生出任總工程師。
1920年,侯德榜先生毅然回國任職。他全身心地投入制鹼工藝和設備的改進上,終於摸索出了索爾維法的各項生產技術。1924年8月,塘沽鹼廠正式投產。1926年,中國生產的“紅三角”牌純鹼在美國費城的萬國博覽會上獲得金質獎章。產品不但暢銷國內,而且遠銷日本和東南亞。
針對索爾維法生產純鹼時食鹽利用率低,制鹼成本高,廢液、廢渣污染環境和難以處理等不足,侯德榜先生經過上千次試驗,在1943年研究成功了聯合制鹼法。這種方法把合成氨和純鹼兩種產品聯合生產,提高了食鹽利用率,縮短了生產流程,減少了對環境的污染,降低了純鹼的成本。聯合制鹼法很快為世界所採用。
原理
是依據離子反應發生的原理進行的,離子反應會向著離子濃度減小的方向進行。也就是很多國中高中教材所說的複分解反應應有沉澱,氣體和難電離的物質生成。他要制純鹼(Na2CO3),就利用NaHCO3在溶液中溶液中溶解度較小,所以先製得NaHCO3。再利用碳酸氫鈉不穩定性分解得到純鹼。要製得碳酸氫鈉就要有大量鈉離子和碳酸氫根離子,所以就在飽和食鹽水中通入氨氣,形成飽和氨鹽水,再向其中通入二氧化碳,在溶液中就有了大量的鈉離子,銨根離子,氯離子和碳酸氫根離子,這其中NaHCO3溶解度最小,所以析出,其餘產品處理後可作肥料或循環使用。
氨鹼法
氨鹼法又稱索爾維制鹼法
1862年,比利時人索爾維(Ernest Solvay,1832-1922)以食鹽、氨、二氧化碳為原料,製得了碳酸鈉,是為氨鹼法(ammomia soda process)。
反應分三步進行:
NH3+CO2+H2O===NH4HCO3
NH4HCO3+NaCl===NaHCO3+NH4Cl
2NaHCO3===Na2CO3+CO2 +H2O
反應生成的CO2可以回收再用,而NH4Cl又可以與生石灰反應,產生NH3,重新作為原料使用:2NH4Cl+CaO===2NH3+CaCl2+H2O
氨鹼法使生產實現了連續性生產,食鹽的利用率得到提高,產品質量純淨,因而被稱為純鹼,但最大的優點還在於成本低廉。
1867年索爾維設廠製造的產品在巴黎世界博覽會上獲得銅製獎章,此法被正式命名為索爾維法。此時,純鹼的價格大大下降。訊息傳到英國,正在從事路布蘭法制鹼的英國哈琴森公司取得了兩年獨占索爾維法的權利。1873年哈琴森公司改組為卜內門公司,建立了大規模生產純鹼的工廠,後來,法、德、美等國相繼建廠。這些國家發起組織索爾維公會,設計圖紙只向會員國公開,對外絕對保守秘密。凡有改良或新發現,會員國之間彼此通氣,並相約不申請專利,以防泄露。除了技術之外,營業也有限制,他們採取分區售貨的辦法,例如中國市場由英國卜內門公司獨占。由於如此嚴密的組織方式,凡是不得索爾維公會特許權者,根本無從問津氨鹼法生產詳情。多少年來,許多國家要想探索索爾維法奧秘的廠商,無不以失敗而告終。