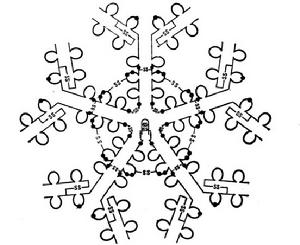
基本介紹
IgM占血清免疫球蛋白總量的6%,主要存在血管內,是機體受抗原刺激後最先產生的抗體,起“先鋒免疫”作用,具有很強的細胞毒活性和細胞溶解活性,由於IgM主要存在在血管內,是抗血管內感染的第一線抗體,對防止敗血症的發生有重要作用。
IgM是存在於大多數廣物血清中的第二高濃俊的免疫球蛋白.它是19S分子,分子最為190,000道爾頓,由五個7S亞單位所組成,它的每一個亞單在結構上與基本的Y字形免疫球蛋白分子相似,所不同的是它們有四個CⅡ門源單位。而不是三個,以及它們有著μ抗原決定簇。IgM單體被雙硫鍵環形地連線成星狀,並由一個小形的富含半胱氨酸的多肽叫作J鏈(15,000道爾頓)的,把兩個這樣的單位連起來。IgM分子從漿細胞分泌出來就是——個完整的整體,所以應該認為J鏈是這個分子不可缺少的——部分。
IgM是一級免疫應答中所產生的主要免皮球蛋白,它也產生於二級免疫應答,但往往被二級應答中大量生成的IgG所掩蓋,盡竹生成的數量較少,但IgM在激活補體、調理作用、中和病毒和凝集作用等方面,比IgG要有效得多(在克分子基礎上)。因為它們的形體很大,所以IgM分子主要是被限制么血管系統,因此,它對組織液或分泌物所提供的保護作用意義不大。工gM單體(7SIgM)還在B細胞上起一種抗原受體的作用。
結構特點
(1)它由IgM單體形成一個封閉的五聚體環狀結構,沉降係數是19S,相對分子
(2)五聚體分子的每一個單體都有同型的輕鏈:入λ或x。重鏈和輕鏈都有V和C結構域。重鏈稱為弘鏈,其穩定區有4個,分別為C,l、巳2、C.3、和C,4,它的絞鏈區在C。2和C,3之間。
(3)在形成五聚體之前,首先由一個j 鏈(joiningchain)連線形成二聚體,
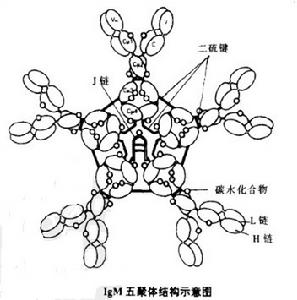
(4)分泌型IgM是五聚體,膜結合的IgM是單體。分泌型IgM的C端含20個胺基酸殘基的尾片,膜結合的IgM含41個胺基酸尾片,並帶有一個非常疏水的核心,約有25個胺基酸殘基插入膜中。
(5)IgM類有2個亞類:IgM1和IgM2。
生理功能
(1)它是對免疫原最早出現的抗體,所以它是機體初次應答的重要抗體。抗體出現得愈早,對機體保護也愈有效,故IgM有“先鋒免疫作用”的美譽。(2)IgM作為五聚體,由於空間障礙只表現為5價而非10價,但如遇到小的抗原分子(<1500),則可表現為10價。
(3)B淋巴細胞表面缺乏Fc。受體,但大多數靜止的B細胞表面具有表面IgM,這些表面分子是與膜結合的。它的功能是作為抗原受體,提供使淋巴細胞轉化成分泌抗體的漿細胞所需要的信號的—‘部分(此信號的另一部分是通過T細胞所提供)。此漿細胞產生分泌抗體的特異性於表面IgM相同,只是類型不同(如IgG、IgA等),此過程稱為“類別轉換”。在B淋巴細胞的成熟過程中,首先在細胞漿內出現IgM,然後出現在細胞膜上,當膜上同時表達IgD時,B細胞完全成熟。當受抗原刺激時,它可以產生分泌型的IgM,也可通過“類型開關。(classswitch)轉化為不同類的抗體分泌細胞。這一轉換過程可為機體提供功能各異的特異性不同的各類免疫球蛋白。
絕大多數抗原需要T細胞輔助才能刺激B細胞產生相應的抗體,這類抗原稱為胸腺依賴性抗原(thymus—dependentantigen,TD抗原)。TD抗原刺激機體所產生的抗體多為IgG類,它還可刺激機體產生細胞免疫,且有記憶性,當TD抗原再次刺激機體時,可引起回憶應答。另一類抗原其分子結構的特點是有重複結構(如細菌多糖、聚合鞭毛蛋白等),它無需或低程度地依賴T細胞的輔助,便可激活機體產生抗體。這類抗原稱為非胸腺依賴性抗原(thymus—independentantigen,TⅡ抗原),它刺激機體產生的抗體只有IgM一個類型,TⅡ激活B細胞產生抗體的現象,有人解釋為T1分子的重複結構,使結合在B細胞膜的受體出現交叉連線,致使細胞被激活,分泌IgM類抗體。
(4)IgM和IgG一樣,可以中和毒素和病毒,以對機體有效的保護。在單核細胞、巨噬細胞有其受體(Fc,R),IgM具有促吞噬細胞的吞噬作用。在淋巴細胞的檢測中,用包被有IgM的公牛紅細胞作玫瑰花的實驗檢測,大約有50%的人外周T細胞和小量的B細胞具有Fc,受體。一般認為輔助性T細胞能與Fc,結合。IgM親細胞位點可能在C,4功能區。由於IgM是五聚體,因此在凝集反應和溶菌反應中它的效力很高。在溶細胞能力上比IgG高1000倍。IgM的溶細胞作用是由於它可以激活補體。它結合補體過程不同與IgG,IgG需要2個以上的分子經集聚才能激活補體,IgM只需1個分子便可激活補體。分泌型IgM在血液循環中形成了五聚體,但IgM的三維結構阻礙了與Clq的結合,故游離的五聚體IgM不能結合補體。當IgM和平展表面(如細胞表面)結合後,會改變IgM的構象,使Clq可以接近Fc區,Clq最後結合在IgM的C,3區,引發補體的激活。IgM不能通過胎盤,在胎兒的保護方面它無能為力。但在初乳中富含IgM,可被嬰兒吸收。嬰兒出生後IgM升高很快,l歲時已達成年人90》《水平。A、B血型人類的天然血型抗體是IgM,由於它不能通過胎盤,不會產生新生兒溶血症。
(5)變態反應Ⅱ、Ⅲ型以及自身免疫疾病患者的特異抗體除IgG外,還有IgM類(如類風濕因子80“是IgM類抗體)。所以IgM類抗體也會對機體自身造成免疫損傷。
參考正常值
免疫比濁法,放射免疫擴散法(RID法):臍帶: 40~240mg/L (4~24mg/dl)。
新生兒: 50~300mg/L (5~30mg/dl)。
0.5~6個月:150~1090mg/L (15~109mg/dl)。
6個月~2歲:430~2390mg/L (43~239mg/dl)。
2~6歲: 500~1990mg/L (50~199mg/dl)。
6~12歲: 500~2600mg/L (50~260mg/dl)。
12~16歲: 450~2400mg/L (45~240mg/dl)。
成人: 400~3450mg/L (40~345mg/dl)。
(註:具體參考值請根據各實驗室而定,)
測定及臨床意義
臨床上,IgM常用ELISA測定,ELISA是酶聯免疫吸附劑測定( Enzyme-Linked Immunosorbnent Assay )的簡稱,它是繼免疫螢光和放射免疫技術之後發展起來的一種免疫酶技術。ELISA是以免疫學反應為基礎,將抗原,抗體的特異性反應與酶對底物的高效催化作用相結合起來的一種敏感性很高的試驗技術,由於抗原,抗體的反應在一種固相載體——聚苯乙烯微量滴定板的孔中進行,每加入一種試劑孵育後,可通過洗滌除去多餘的游離反應物,從而保證試驗結果的特異性與穩定性。
(1)升高:巨球蛋白血症,系統性紅斑狼瘡(SLE),類風濕性關節炎,硬皮病 ,急 慢性肝病(病毒性肝炎,膽汁性肝硬化,隱匿性肝硬化, 惡性腫瘤,傳染性單核細胞增多症,梅毒,黑熱病,錐蟲病,傷寒,弓形體病,乙型腦炎,單核細胞性白血病,霍奇金病等,臍帶血IgM升高:革蘭陰性桿菌感染,梅毒,風疹,巨細胞病毒感染,單純皰疹,弓形體等宮內感染等,
(2)降低:原發性無丙種球蛋白血症,非IgA和IgG型多發性骨髓瘤,霍奇金病,慢性淋巴細胞白血病,蛋白喪失性胃腸病等。
【標本採集】靜脈血2ml,不抗凝,分離血清進行測定。
【正常參考值】單向免疫擴散法(血清):0.48~2.12g/L。
【影響因素】見表
| 檢驗結果 | 樣本採集前 | 樣本採集 | 樣本測定 |
| 增高 | 伴隨感染者患者;高脂血症患者 | 採集樣本時溶血;未空腹採血 | ELISA法測定中洗滌不徹底 |
| 降低 | 套用免疫抑制劑治療時檢測;新生兒,嬰幼兒;感染晚期檢測 | —— | 標本反覆凍融;抗血清效價降低 |
免疫球蛋白分類
免疫球蛋白(Ig)指具有抗體(Ab)活性或化學結構,與抗體分子相似的球蛋白。免疫球蛋白是由兩條相同的輕鏈和兩條相同的重鏈通過鏈間二硫鍵連線而成的四肽鏈結構。免疫球蛋白分為五類,即免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)。