詞條名片
ⅠA族元素指元素周期表中的鹼金屬。包括鋰、鈉、鉀、銣、銫、鍅。前五種存在於自然界,鍅只能由核反應產生。鹼金屬是金屬性很強的元素,其單質也是典型的金屬,表現出較強的導電、導熱性。鹼金屬的單質反應活性高,在自然狀態下只以鹽類存在,鉀、鈉是海洋中的常量元素,在生物體中也有重要作用;其餘的則屬於輕稀有金屬元素,在地殼中的含量十分稀少。 因為鹼金屬最外層只有1個電子,所以鹼金屬都能和水發生激烈的反應,生成強鹼性的氫氧化物,並隨相對原子質量增大反應能力越強。在氫氣中,鹼金屬都生成白色粉末狀的氫化物。鹼金屬都可在氯氣中燃燒。由於鹼金屬化學性質都很活潑,為了防止與空氣中的水發生反應,一般將他們放在煤油或石蠟中保存。氫雖然是第1族元素,但它在普通狀況下是雙原子氣體,不會呈金屬狀態,也不屬於鹼金屬。只有在極端情況下(1.4兆大氣壓力),電子可在不同氫原子之間流動,變成金屬氫。有些在液氨中會形成電子鹽。
單質
鋰
 鋰
鋰鋰,原子序數3 ,為銀白色的金屬,是最輕的金屬。可與大量無機試劑和有機試劑發生反應。與水的反應非常劇烈。但由於氫氧化鋰微溶於水,反應在進行一段時間後,鋰表面被氧化鋰覆蓋,反應速度減慢。在500℃左右容易與氫發生反應,是唯一能生成穩定得足以熔融而不分解的氫化物的鹼金屬,電離能5.392電子伏特,與氧、氮、硫等均能化合,是唯一的與氮在室溫下反應,生成氮化鋰(LiN)的鹼金屬。由於易受氧化而變暗,且密度比煤油小,故應存放於液體石蠟中。外圍電子層排布:2s 電子層:K-L 0族電子數:2-8
製取
用電解法製備金屬鋰。 將氯化鋰LiCl在不超過其熔點(602℃)的溫度下灼燒乾燥1h。使用經過KOH脫水乾燥的、新蒸餾的吡啶溶解上述氯化鋰,製成11.81%的氯化鋰的吡啶溶液作為電解液。用石墨板作陽極,光潔的鉑片或鐵片作陰極,無隔膜。電解時採用的電壓為1.4V,電流密度為0.2~0.3A/100cm 。
鈉
 鈉
鈉鈉,原子序數11 ,是一種金屬元素,質地軟,能使水分解釋放出氫。在地殼中鈉的含量為2.83%,居第六位,主要以鈉鹽的形式存在,如食鹽(氯化鈉)、智利硝石(硝酸鈉)、純鹼(碳酸鈉)等。鈉也是人體肌肉和神經組織中的主要成分之一。外層電子排布為:3s 0族電子數:2-8-8 電子層:K-L-M
製取
通過電解熔融的氯化鈉(食鹽)或熔融氫氧化鈉製得。 反應方程式:熔融狀態下,2NaCl = = 2Na + Cl(當斯法);2NaOH = = 2Na + O+ H(卡斯納法)
鉀
鉀,原子序數19, 是一種化學元素 。化學符號(K),原子序數 19,相對原子質量為39.0983,屬周期系ⅠA族,為鹼金屬的成員。元素的英文名稱來源於potash一詞,含義是木灰鹼。鉀在地殼中的含量為2.59%,占第七位。在海水中,除了氯、鈉、鎂、硫、鈣之外 ,鉀的含量占第六位 。外圍電子層排布為:4s 0族電子數:2-8-18-8 電子層:K-L-M-N
製取
 氫氧化鉀
氫氧化鉀這種元素通過將其常見的氫氧化物進行電解而得到。將氫氧化鉀與鹵化物進行熔融電解,再經真空蒸餾製得。
銣
銣,原子序數37, 是一種化學物質,銀白色蠟狀金屬。質軟而輕,其化學性質比鉀活潑。在光的作用下易放出電子。遇水起劇烈作用,生成氫氣和氫氧化銣。易與氧作用生成氧化物。由於遇水反應放出大量熱,所以可使氫氣立即燃燒。純金屬銣通常存儲於煤油中。外圍電子層排布為:5s 0族電子數:2-8-18-18-8 電子層:K-L-M-N-O
製取
提取銣的化合物:主要方法有復鹽沉澱法、溶劑萃取法、離子交換法等多種。中國自貢從滷水回收銣採用磷鉬酸銨沉澱法。制銣:用金屬熱還原法以鈣還原氯化銣,用鎂或碳化鈣還原碳酸銣,均可製得金屬銣。
銫
銫,英文名Cesium,元素符號Cs,原子序數為55,原子量為132.90543。白質軟,熔點低,在空氣中容易氧化。是製造真空件器、光電管等的重要材料,化學上用做催化劑。外圍電子層排布為:5s 0族電子數:2-8-18-32-18-8 電子層:K-L-M-N-O
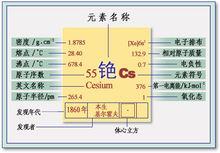 銫的性質
銫的性質 銫
銫鍅
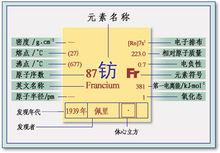 鍅的性質
鍅的性質原子序數87, 由於核不穩定,Fr-223的半衰期最長僅有21分鐘。其化學性質只能在痕量範圍內研究。是最重的鹼金屬元素,也是最不穩定的鹼金屬。鍅的化學性質活潑,所有的鍅鹽都是水溶性的。由於它有放射性,而且化學反應極度活躍,故此至今無法製得純鍅。外圍電子層排布為:6s
