發現歷史
發現人:索里特(J.L.Soret)、克利夫(P.T.Cleve)
發現年代:1878至1879年。
發現過程:1878年為索里特(J.L.Soret)發現;1879年又被克利夫(P.T.Cleve)發現。
1842年莫桑德爾從釔土中分離出鉺土和鋱土後,不少化學家利用光譜分析鑑定,確定它們不是純淨的一種元素的氧化物,這就鼓勵了化學家們繼續去分離它們。在從氧化餌分離出氧化鐿和氧化鈧以後,1879年克利夫又分離出兩個新元素的氧化物。其中一個被命名為holmium,以紀念克利夫的出生地,瑞典首都斯德哥爾摩古代的拉丁名稱Holmia,元素符號Ho。其後1886年布瓦博德朗又從鈥中分離出了另一元素,但鈥的名稱被保留了。隨著鈥以及其他一些稀土元素的發現,完成了發現稀土元素第三階段的另一半。
性質
物理性質
鈥為銀白色金屬,質較軟,有延展性;熔點1474°C,沸點2695°C,密度8.7947g/㎝³。鈥在乾燥空氣中穩定,高溫時很快氧化;氧化鈥是已知順磁性最強的物質。鈥的化合物可做新型鐵磁材料的添加劑;碘化鈥用於製造金屬鹵素燈—鈥燈。
 鈥塊
鈥塊讀音:huǒ
CAS號:7440-60-0
體積彈性模量:Gpa:40.2
原子化焓:kJ /mol @25℃:301
熱容:J /(mol· K):27.15
導電性:10 /(cm ·Ω ):0.0124
導熱係數:W/(m·K):16.2
熔化熱:(千焦/摩爾):12.20
汽化熱:(千焦/摩爾):241.0
原子體積:(立方厘米/摩爾):18.7
元素在宇宙中的含量:(ppm):0.0005
元素在海水中的含量太平洋表面 0.00000016
地殼中含量(ppm):1.4
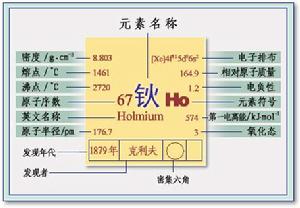 鈥
鈥晶體結構:晶胞為六方晶胞。
氧化態:Main Ho+3
聲音在其中的傳播速率:(m/S) 2760
電離能 (kJ /mol)
M - M 580.7
M - M 1139
M - M 2204
M - M 4100
相對原子質量:164.93
常見化合價: +3
電負性: 1.23
外圍電子層排布:4f11 6s2
核電荷數:67
電子層:K-L-M-N-O-P
核外電子排布: 2,8,18,29,8,2
同位素及放射線:Ho-163[4570y] Ho-165 Ho-166[1.1d]
電子親合和能:0 KJ·mol-1
第一電離能:581 KJ·mol-1
第二電離能:1139 KJ·mol-1
第三電離能:0 KJ·mol-1
單質密度:8.54 g/cm
單質熔點: 1470.0 ℃
單質沸點: 2720.0 ℃
原子半徑:2.47Å(埃)
共價半徑: 1.58Å
維氏硬度:481MPa
穩定性
常溫下在乾燥空氣中穩定,在潮濕空氣中和高溫下易被氧化。避免與空氣、氧化物、酸、鹵素、潮濕的水分接觸,和水接觸時釋放可燃性氣體;溶於無機酸。在室溫下乾燥空氣中穩定,但在潮濕空氣中和高於室溫時迅速氧化。化學性質活潑。使水緩慢分解。可以與幾乎所有非金屬元素化合。存在於矽鈹釔礦、獨居石和其他的稀土礦物中。用於製作磁性合金材料。
化學性質
它和鏑一樣,是一種能夠吸收核分裂所產生的中子的金屬。
在核子反應爐中,一方面不斷燃燒,一方面控制連鎖反應的速度。
元素描述:第一電離能6.02ev。有金屬光澤。與水能緩慢起作用,溶於稀酸。鹽類是黃色。氧化物HoO為淡綠色。溶於礦物酸而產生三價離子黃色鹽。
元素來源:由氟化鈥HoF·2HO用鈣還原而製得。
化合物
(1)氧化鈥;holmium oxide
為白色體心立方和單斜兩種結構。Ho2O3是惟一的一種穩定的氧化物。化學性質及製備方法同於氧化鑭。可製做鈥燈。
(2)硝酸鈥;holmium(iii) nitrate pentahydrate
分子式:Ho(NO)·5HO;分子質量:441.02;
通常對水體是稍微有害的,不要將未稀釋或大量產品接觸地下水,水道或污水系統,未經政府許可勿將材料排入周圍環境。
(3)二氯化環戊二烯基鈥;cyclopentadienyl-holmium dichloride
分子式:(CH)HOCl
性質:黃色晶體。熔點84~92℃,對空氣極為敏感。由三氯化鈥與環戊二烯基鈉反應得到其三分子四氫呋喃加合物。
合成方法
1、以金屬鈣還原無水三氯化鈥或三氟化鈥可得金屬鈥
2、通過離子交換或溶劑萃取技術將鈥與其他稀土元素分離後,可用金屬熱還原法製備金屬鈥。鋰熱還原稀土氯化物與鈣熱還原稀土氯化物不同,前者的還原過程是在氣相中進行的。鋰熱還原反應器分兩段加熱區,還原和蒸餾過程在同一設備中進行。無水氯化鈥放在上部的鈦制反應器坩堝中(亦是HoCl蒸餾室),還原劑金屬鋰放置在下部的坩堝中,然後將不鏽鋼反應罐抽真空至7Pa後開始加熱。溫度達到1000℃時保持一定時間,使HoCl蒸氣與鋰蒸氣充分反應,還原出來的金屬鈥固體顆粒落在下部的坩堝中。還原反應完成後,只加熱下部坩堝,把LiCl蒸餾到上部坩堝。還原反應過程一般需要10h左右。為了製得較純的金屬鈥,還原劑金屬鋰要用99.97%高純鋰,並使用二次蒸餾的無水HoCl。
用途
主要用途
鈥Ho是稀土元素,目前鈥的主要用途有:
(1)、用作金屬鹵素燈添加劑,金屬鹵素燈是一種氣體放電燈,它是在高壓汞燈基礎上發展起來的,其特點是在燈泡里充有各種不同的稀土鹵化物。目前主要使用的是稀土碘化物,在氣體放電時發出不同的譜線光色。在鈥燈中採用的工作物質是碘化鈥,在電弧區可以獲得較高的金屬原子濃度,從而大大提高了輻射效能。
(2)、鈥可以用作釔鐵或釔鋁石榴石的添加劑;
 鈥
鈥(3)、摻鈥的釔鋁石榴石(Ho:YAG)可發射2μm雷射,人體組織對2μm雷射吸收率高,幾乎比Hd:YAG高3個數量級。所以用Ho:YAG雷射器進行醫療手術時,不但可以提高手術效率和精度 ,而且可使熱損傷區域減至更小。鈥晶體產生的自由光束可消除脂肪而不會產生過大的熱量,從而減少對健康組織產生的熱損傷,據報導美國用鈥雷射治療青光眼,可以減少患者手術的痛苦。中國2μm雷射晶體的水平已達到國際水平,應大力開發生產這種雷射晶體。
(4)、在磁致伸縮合金Terfenol-D中,也可以加入少量的鈥,從而降低合金飽和磁化所需的外場。
(5)、另外用摻鈥的光纖可以製作光纖雷射器、光纖放大器、光纖感測器等等光通訊器件在光纖通信迅猛的今天將發揮更重要的作用。
鈥雷射
 鈥雷射打孔
鈥雷射打孔鈥雷射碎石技術:醫用鈥雷射碎石,它適用於體外衝擊波碎石法無法碎解的、堅硬的腎結石、輸尿管結石和膀胱結石。醫用鈥雷射碎石時,醫用鈥雷射的纖細光纖藉助膀胱鏡和輸尿管軟鏡通過尿道、輸尿管直抵膀胱結石、輸尿管結石和腎結石部位,然後由泌尿外科專家操縱鈥雷射將結石擊碎。這種 治療方法的優點是可以解決輸尿管結石、膀胱結石和絕大部分的腎結石。其缺點是對於部分腎上盞和腎下盞的結石,由於從輸尿管進入的鈥雷射光纖無法抵達結石部位,會有少量結石殘留。
鈥雷射是以釔鋁石榴石(YAG)為激活媒質,摻敏化離子鉻(Cr)、傳能離子銩(Tm)、激活離子鈥(Ho)的雷射晶體(Cr:Tm:Ho:YAG)製成的脈衝固體雷射裝置產生的新型雷射。可套用於泌尿外科、五官科、皮膚科、婦科等科室手術。該雷射手術為無創或微創手術,病人的治療痛苦非常小。
貯存方法
儲存於陰涼、通風的庫房。遠離火種、熱源。應與氧化劑、酸類、鹵素等分開存放,切忌混儲。採用防爆型照明、通風設施。禁止使用易產生火花的機械設備和工具。儲區應備有合適的材料收容泄漏物。
毒理性
細胞毒性
硝酸鈥的毒性在細胞和亞細胞水平上很容易被檢測到。有研究表明,當用濃度高於4mg/L硝酸鈥處理蠶豆根尖時。即能引起根尖質地變硬、顏色變黑、生長減慢、細胞分裂指數下降等現象,而且隨著劑量的增加或染毒時間的延長,根尖細胞受損傷的程度呈加重趨勢。在細胞壓片中還觀察到,細胞核凝縮、深染,核質顆粒減少,核仁、核質不清晰,細胞聚集成塊。組織纖維化漸重等現象。在動物的體內試驗中也出現了類似的結果,當用劑量>20mg/kg體重的硝酸鈥處理小鼠時,發現硝酸鈥能夠抑制骨髓細胞的增殖。另外,在顯微鏡下還可觀察到淋巴細胞核凝縮、深染、碎裂、染色質邊集、外突、內陷等異常現象,而且伴隨著劑量的增加核異常的程度和比例呈現上升趨勢。所有這些表明,硝酸鈥對細胞具有一定的毒性作用,這與鑭、鈰、鉺其他14種稀土元素毒性報導一致。
生化毒性
動物的實驗發現,在一定劑量作用下硝酸鈥具有提高超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)的活性,可以清除多餘的超氧陰離子自由基(O ·)及抑制脂質過氧化。當對小鼠注射了低劑量(10-40mg/kg體重)的硝酸鈥,小鼠肝臟中的SOD、POD、CAT的活性升高,當劑量達到80、160mg/kg體重時,3種抗氧化酶的活性都受到了抑制。說明低劑量的鈥可以減少自由基對生物大分子和細胞的氧化損傷,但高劑量的鈥卻使抗氧化酶活性下降,從而使自由基在機體內積累,破壞了細胞結構和功能,導致突變發生,說明鈥在高劑量下又具有一定的致突變作用。
![Ho[元素符號] Ho[元素符號]](/img/b/3d7/nBnauM3X0QDO3ETN5IjNxYDO1UTM1QDN5MjM5ADMwAjMwUzLyYzLxIzLt92YucmbvRWdo5Cd0FmLxE2LvoDc0RHa.jpg)
