分型
⒈ 按細胞大小(FAB、我國標準)
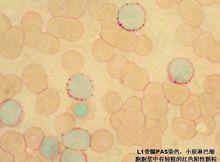
①L1 原幼淋細胞以小細胞為主,大細胞﹤0.25(25%)。
②L2 原幼淋細胞以大細胞為主>0.25(25%)。
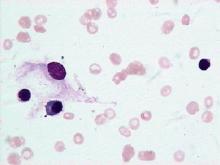 急性淋巴細胞性白血病
急性淋巴細胞性白血病③L3 大細胞為主,胞質較多、深藍色,多空泡呈蜂窩狀,稱 BurKitt 型。
⒉ 按細胞表型(WHO標準)
① 前體B--ALL:細胞形態學如 L1 或 L2,免疫表型為B系:CD19、CD22、CD79a、CD10 陽性,TdT^+。占 ALL 中80%~~85%。
② 前體T-ALL:細胞形態學如 L1 或 L2 ,免疫表型為T系:CD3、CD7、CD4、CD8陽性,TDT 亦可陽性,占 ALL 中 15%~~20%。
WHO將 L3 (BurKitt 型)歸入成熟 B 細胞腫瘤中。
臨床表現
各型ALL的臨床表現雖有一定差異,但基本是相同的。分述如下:
1、一般症狀除T-ALL起病較急外,一般起病相對緩慢。早期多表現為倦怠、無力或煩躁、食欲不振、偶有嘔吐。亦有最初表現為病毒性上呼吸道感染的症狀,或出現皮疹,然後出現無力等症狀。骨、關節疼也是較常見症狀。
2、貧血早期即出現進行性蒼白,以皮膚和口唇黏膜較明顯,隨著貧血的加重可出現活動後氣促,虛弱無力等症狀。T-ALL由於發病較急,確診時貧血反而不嚴重。
3、發熱半數以上有發熱、熱型不定。發熱的原因主要是繼發感染。
4、出血約半數病人有鼻衄、牙齦出血和皮膚紫癜或瘀點、瘀斑,偶見顱內出血。出血原因除血小板的質與量異常外,亦可由於白血病細胞對血管壁的浸潤性損害,使滲透性增加。T-ALL偶可發生DIC,可能由於原始T-ALL細胞釋放凝血酶、激酶等物質所致。
5、白血病細胞在臟器浸潤所致的症狀約2/3患兒有脾臟輕或中度腫大,肝臟多輕度腫大,質軟。淋巴結腫大多較輕,局限於頸、頜下、腋下、腹股溝等處。有腹腔淋巴結浸潤者常訴腹痛。約有1/4的患兒以骨或關節痛為起病的
主要症狀
這是由於白血病細胞浸潤骨膜或骨膜下出血所致。
顱內壓增高症狀可出現在病程的任何時期,尤其在套用化療而未採取有效的中樞神經系統白血病預防者。T-ALL在發病早期即出現中樞神經系統浸潤,此類患兒多合併縱隔淋巴結腫大或胸腺浸潤,而產生呼吸困難、咳嗽等症狀。
睪丸浸潤可致睪丸無痛性腫大。隨著病程的延長,若不採用有效預防措施,睪丸白血病的發生將增多。合併睪丸白血病的平均病程為13個月,大多在骨髓處於完全緩解時發生。若不及時治療,則可導致骨髓復發。
診斷鑑別
典型病例根據病史、血象和骨髓象診斷並不困難。但有些病例在發病早期外周血白細胞數正常或減少,且可不出現幼稚細胞,常常被誤診。因此遇到一些可疑的病例,如不明原因的發熱、貧血、出血、骨關節痛、肝脾淋巴結腫大等應早期提高警惕,考慮到白血病,及時做骨髓穿刺檢查以明確診斷。骨髓檢查對於診斷十分重要,但應注意白血病細胞在體內分布不均勻現象。對於不典型病例應與下列疾病鑑別:
1、再生障性貧血出血、貧血、發熱和全血減少與白細胞減少的ALL相似。但肝、脾和淋巴結不腫大,骨髓中無幼稚細胞增多。
2、惡性腫瘤骨轉移如神經母細胞瘤,可出現全血減少,並可有突眼,外周血出現特殊細胞。但骨髓檢查,瘤細胞多成堆或呈菊團狀排列,尿VMA增高,且多可找到原發瘤。
3、風濕與類風濕關節炎發熱、關節痛、貧血、白細胞增高等與ALL類似,但肝、脾、淋巴結多不腫大,行骨髓檢查則不難區別。
4、傳染性單核細胞增多症肝脾、淋巴結腫大,白細胞增多並出現異型淋巴細胞,有時易與ALL混淆。但多無血小板減少,骨髓檢查無原幼淋巴細胞增多,嗜異凝集反應陽性。
5、傳染性淋巴細胞增多症雖有白細胞總數增多,淋巴細胞增高。但皆為成熟的小淋巴細胞,且無貧血和血小板減少,骨髓檢查不難鑑別。
輔助檢查
基本特點
 白細胞
白細胞1、血象白細胞的改變是本病的特點。白細胞總數可高於100×109/L,亦可低於1×109/L。約30%在5×109/L以 下。未成熟淋巴細胞在分類中的比例可因診斷早晚和分型而不同。多數超過20%,亦有高達90%以上者。少數病人在早期不存在未成熟淋巴細胞,此類白血病分類中以淋巴細胞為主。
正常範圍
貧血一般為正細胞正色素性。但嚴重者,其MCV可能增高,可能由於骨髓紅細胞生成障礙所致。網織紅細胞正常或低下。貧血程度輕重不一,發病急者,貧血程度較輕。血小板大多減少,約25%在正常範圍。
重要依據
2、骨髓象骨髓檢查是確立診斷和評定療效的重要依據。骨髓增生活躍或極度活躍,少數可表現增生低下。分類以原始和幼稚淋巴細胞為主,多超過50%以上,甚至高達90%以上。有的骨髓幾乎全部被白血病細胞所占據,紅系和巨核細胞不易見到。
化學特徵
3、組織化學染色主要用於研究骨髓細胞的生物化學性質,有助於鑑別不同類型的白血病。ALL的組織化學特徵為
① 過氧化酶染色和蘇丹黑染色陰性;
② 糖原染色(±)~(■);
③ 酸性磷酸酶(-)~(±),T細胞胞漿呈塊狀或顆粒狀,其它亞型為陰性;
④ 非特異性脂酶陰性,加氟化鈉不抑制。4、其他檢查出血時間延長可能由於血小板質與量異常所致。白血病細胞浸潤可造成凝血酶原和纖維蛋白原減少,從而導致凝血酶原時間延長和出血。肝功能檢查SGOT輕度或中度升高。由於骨髓白血病細胞大量破壞,致使LDH增高。
胸部X線檢查有5%~15%的患兒可見縱隔腫物,為胸腺浸潤或縱隔淋巴結腫大。長骨片約50%可見廣泛骨質稀疏,骨幹骺端近側可見密度減低的橫線或橫帶,即“白血病線”。有時可見骨質缺損及骨膜增生等改變。
治療
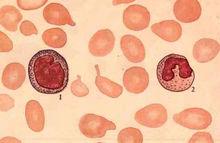 骨髓增生血象
骨髓增生血象近20年來,由於新的抗白血病藥物不斷出現,新的化療方案和治療方法不斷改進,ALL的預後明顯改善。現代的治療已不是單純獲得緩解,而是爭取長期存活,最終達到治癒,並高質量生活。
治療核心
聯合化療 是白血病治療的核心,並貫徹治療的始終。其目的是儘量殺滅白血病細胞,清除體內的微量殘留白血病細胞,防止耐藥的形成,恢復骨髓造血功能,儘快達到完全緩解,儘量少損傷正常組織,減少治療晚期的後遺症。
緩解標準
(1)完全緩解(CR)①臨床無貧血、出血、感染及白血病細胞浸潤表現;②血象血紅蛋白>90g/L,白細胞正常或減低,分類無幼稚細胞,血小板>100×109/L;③骨髓象原始細胞加早幼階段細胞(或幼稚細胞)<5%,紅細胞系統及巨核細胞系統正常。
(2)部分緩解 臨床、血象及骨髓象3項中有1或2項未達到完全緩解標準,骨髓象中原始細胞加早幼細胞<20%。
(3)未緩解 臨床、血象及骨髓象三項均未達到完全緩解標準,骨髓象中原始細胞加早幼細胞>20%,其中包括無效者。
常用抗白血病化療藥物有關藥物的介紹詳見腫瘤篇概述。這類藥物在白血病治療時的用法、劑量、適應證及其副作用,參閱腫瘤篇常用抗癌藥物簡表(表33-2)。
設計化療方案時,應考慮周期特異性與周期非特異性藥物聯合套用,選擇周期特異性藥物時,應選用不同時相的藥物配伍。
化療方案
化療方案急淋的治療分為4部分:
① 誘導治療;
② 鞏固治療;
③ 庇護所預防;
④ 維持和加強治療。
正確的診斷、分型是選擇治療方案的基礎。應當根據每個病人的具體情況設計方案,即“個體化”。
(1)誘導緩解治療急性白血病初診時,體內有1012以上的白血病細胞。本期的目的是在短期內迅速大量殺滅白血病細胞,恢復骨髓正常造血功能和臟器功能。兒童ALL的誘導緩解比較容易,簡單的VP方案(VCR+Pred)即可使CR率達到95%左右。但套用較弱的方案時,體內殘存的白血病細胞較多,且容易形成多藥耐藥,因而易於復發。許多研究證實,白血病的治療關鍵在於早期階段。因此主張在治療早期採用強烈、大劑量、聯合方案,在短期內達到CR,最大程度地殺滅白血病細胞,減少微量殘留白血病細胞數量,防止耐藥形成。
A、標危ALL:常用的方案有
①VCLP:VCR每次1.5~2mg/m2,靜注,每周一次,共4次;CTX600~800mg/m2,於治療第一天靜注;Pred40~60mg/(m2·d),口服,共4周;L-Asp10,000u/m2,靜脈或肌肉注射,於治療第二或三周開始,共6~10次。
 肌肉注射模組
肌肉注射模組② VDLP:即CTX換為DNR每次30~40mg/m2,靜注,連用2日。其它同上。③ CODLP(或COALP):即在VCP基礎上加DNR每次30~40mg/m2,連用2日。
套用上述方案,95%以上的病人於治療2~4周可獲CR。由於開始即套用3~4種藥物,白細胞降低明顯,容易合併感染。L-Asp無骨髓抑制的作用,故主張於治療的第3周開始套用,效果較好。
B、高危ALL:儘可能採用強烈化療,否則即使達到CR,骨髓、中樞神經系統和睪丸白血病的復發率仍很高。因此必須採用4~6種大劑量的化療藥物,如大劑量CTX,Ara-C,DNR、MTX,VM26或VP16、IDR等。常用的方案有:
① COAP:CTX400mg/m2於治療第1、15天靜注;VCR1.5~2mg/m2,每周一次,Ara-c100mg/m2,每12小時一次,肌注或靜注,連用5~7天第1,3周用;Pred60mg/(m2·d),口服,連用4周。
② CODLP:CTX800~1000mg/m2,於治療第一天靜注;DNR每次30~40mg/m2,於第2,3天靜注各一次;VCR,Pred用
法同上;第3周加用L-ASP,連用10天,10,000U/(m2·d)。
 急性淋巴細胞白血病治療藥
急性淋巴細胞白血病治療藥用以上方案,一般於第二周末(一個療程)即可達到CR。如獲得部分緩解,可用原方案再進行一個療程。若治療五天血象無明顯好轉,或4周后骨髓未達到CR,則應改換其他方案,如VM26+Ara-c或IDR+Ara-c等。
(2)鞏固治療經誘導緩解達到CR後,用原誘導方案繼續治療2個療程。套用CODP或PODP等強烈方案者,可給予L-ASP10,000U/(m2·d),靜注或肌注,連用10天。或更換其他方案交替使用。
(3)庇護所預防由於血腦屏障的存在,一般劑量的化療藥物很難通過腦膜,達不到有效的藥物濃度,因而不能有效殺滅中樞神經系統內的白血病細胞,故容易發生中樞神經系統白血病(CNSL)。同樣,由於血睪屏障的存在,加之睪丸組織的溫度低,代謝緩慢,睪丸內的白血病細胞容易形成耐藥,導致睪丸白血病。隨著白血病生存期的延長,CNSL和睪丸白血病的發病數逐漸增高。若不進行庇護所預防,約50%的ALL患兒在CR三年內可發生CNSL;約10%~15%的男孩發生睪丸白血病,成為白血病復發的重要原因,因此庇護所的預防是白血病治療的重要環節。
中樞神經系統白血病的預防:初診時白細胞>25×109/L,血小板低者,B-ALL及T-ALL容易發生CNSL。高危組的發生率明顯高於標危組,且發生時間早。採用強烈化療者,採用大劑量MTX,Ara-C及L-ASP者CNSL發生率較低。
由於部分病例初診時已出現中樞神經系統的侵犯,因此CNSL的預防應從治療開始時即進行。常用的預防方法有:
 急性淋巴細胞白血病化驗單
急性淋巴細胞白血病化驗單① 單純藥物鞘註:一般採用MTX、AraC、DXM三聯鞘注,按兒童腦室容量計算給藥。於治療第一天鞘注一次。待CR後每周鞘注一次,連續四次,以後每8周一次,直至停藥。
② 顱腦放療加鞘註:即CR後用直線加速器或60Co照射,每周5次,連續3周,標危及高危病人總量分別為1800cGy及2000cGy。鞘注於第一天注射一次。放療期間每周一次,共4次。放療後每3個月一次。緩解2年後改為每4個月一次。劑量同前。
③ 大劑量MTX、放療及鞘注並用大劑量MTX靜注既能預防CNSL,又能預防睪丸白血病,是套用最廣泛的方法。中劑量MTX(每次500~1000mg/m2)效果不佳,一般不採用。在鞏固治療完成後套用大劑量MTX每次3g/m2,靜注,共三個療程,間隔10~14天。1/10量靜脈推注,其餘9/10量在6小時內均勻靜脈滴注。為預防大劑量MTX的毒性反應,應給予水化、鹼化。入量3000ml/(m2·d),其中包括5%碳酸氫鈉80~100ml/(m2·d)。一般在注射前3小時先輸入含碳酸氫鈉的液體,鹼化尿液,使尿pH>7.0,比重<1.010。用藥開始36小時後開始四氫葉酸鈣解救,每次15mg/m2,第1次肌注,以後每6小時給藥一次,即42、48、54、60、66小時各給藥一次,靜脈、肌注或口服。於靜注MTX2小時後鞘注一次,此後每8周鞘注一次,直至大劑量MTX後6個月進行顱腦放療。套用大劑量MTX同時用VP方案。
 急性淋巴細胞白血病
急性淋巴細胞白血病由於顱腦放療影響兒童的神經系統發育、智力、生長及性腺發育。因此對於標危病人多數人不再主張用此方法作為預防CNSL的手段。睪丸白血病的預防睪丸白血病多發生於高危病人。作為預防措施必須在緩解後套用大劑量MTX,用法如前述。
(4)維持治療與加強治療經誘導緩解後,體內約有108~1010的微量殘留白血病細胞。如此時停藥,則很快復發,故需要繼續維持治療,最大程度殺滅並最終清除MRLC。為防止產生耐藥性,需採用幾種藥物交替輪換使用。但由於維持治療需要較長時間,強烈的化療會導致嚴重骨髓抑制、免疫功能低下和臟器損害(如肝功能損害),因此不應使用蓄積毒性較大的藥物。為了加強對MRLC的殺死,需要間歇重複原誘導方案,即“再誘導”或“小加強”,並定期給予衝擊性治療,即“強化”治療。
維持治療的方案有多種,最簡單而有效的方法是6MP十MTX,MTX每周20mg/m2,靜脈或口服;MP50~75mg/(m2.d),口服,連用2周,再用原誘導方案或COAP強化一周。每月用藥3周,休息一周。
加強治療的方法差異較大,多用Ara-C+VM26,即VM26每次150mg/m2,Ara-C每次300mg/m2,共用2次,間隔2天。加強治療的間隔時間一般在1年內每3個月1次,以後逐漸延長。由於L-ASP對於清除MDR效果較好,故在維持階段可定期使用。
維持治療應持續多長時間,尚無統一標準,主要根據化療方案的設計而定。一般為2年半~3年半。高危病人持續時間可適當延長。有報告3年停藥與3年以上停藥的復發率幾無差異。
復發治療
骨髓復發
骨髓復發的預後與復發的時間有關。持續完全緩解(Continuedcompleteremission,CCR)3年以上者;尤其停藥後復發者預後較好,約80%以上的病人可以獲得第二次緩解,約40%的病人可以長期存活。若在治療18個月以內復發,則預後不良。由於對多種藥物已經產生耐藥(multipledrugresistance,MDR),獲得第二次緩解的機會較少。即使獲得緩解,大部分病人很快復發。
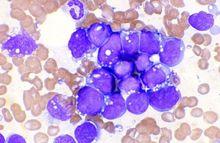 急性淋巴細胞白血病
急性淋巴細胞白血病骨髓復發必須採用更為強烈的再誘導方案,套用二線化療藥物。如美國CCSG協作組對第一次復發的病人套用VDLP方案,其中DNR每周25mg/m2,共用4次;L-ASP10000u/m2,每周3次,共12次,可使82%的病人獲得第二次緩解。VM26與Ara-C並用亦可使再次緩解率達到87%。由於骨髓復發後,再次進行化療獲得長期緩解的機會較少,故有條件的應做骨髓移植。
中樞神經系統復發
半數以上的CNSL病人無明顯症狀,故多被忽視,常在常規鞘注預防CNSL時方被發現。症狀多為頭痛、嘔吐、乏力,亦可出現面癱、視力減退、腦膜刺激征,嚴重的可發生偏癱、失語、抽搐和昏迷。
一般來說,CNSL發生在緩解一年以內者,其長期生存率明顯低於晚期復發者。由於庇護預防的改進,CNSL的發生率已明顯減低。
CNSL的診斷標準為:
① 有中樞神經系統症狀和體徵(尤其是顱內壓增高的症狀和體徵)。
 急性淋巴細胞白血病
急性淋巴細胞白血病②腦脊液的改變:壓力增高,>0.02kPa(200mmH2O),或>60滴/分;白細胞數>0.01×109/L;塗片見到白血病細胞;蛋白>450mg/L,或潘氏試驗陽性。③ 排除其他原因所致中樞神經系統或腦脊液的相似改變。
一般方法
CNSL的治療方法尚不統一,一般的方法包括:
① 聯合鞘註:即MTX、Ara-C、DXM三聯鞘注,劑量同預防。第一周每2天鞘注1次,第二周每周2次,直至CSF正常兩次後,改為每1、2、3、6周各1次,此後每6~8周1次,直至停止化療。或開始每2天鞘注一次,直至CSF正常後改為每4~6周1次。
②放療:對反覆發生CNSL者,經鞘注CSF正常後進行顱腦放療18~26Gy,3周內完成,第4周開始脊髓放療10~18Gy。
③ 腦室內化療:利用Ommaya貯存器植入顱內,直接將藥物注入側腦室,使藥物均勻分布於整個蛛網膜下腔,並可減少反覆腰椎穿刺。但有一定危險性,導管位置不易固定,有合併感染的危險等。
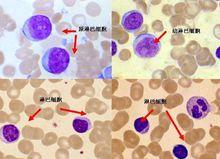 急性淋巴細胞白血病
急性淋巴細胞白血病③ 單純睪丸復發睪丸復發多在緩解2年以後,停藥後復發者比較多見。因此不能放鬆對睪丸的檢查。臨床多無自覺症狀,僅出現硬腫。開始多為一側腫大,若不進行治療,對側也可波及。 睪丸白血病的治療主要為睪丸放療。一側睪丸復發時,應進行對側睪丸活檢。若僅為一側發生浸潤,則對患側進行放療。由於睪丸活檢往往不能反映整個睪丸的情況,因此主張對兩側睪丸同時放療,總量20~24Gy。若發現臨近部位及附近的淋巴結有白血病細胞浸潤,則放療亦應包括這些部位。
建議
凡CNSL或睪丸白血病復發者,無論有無骨髓復發皆應進行全身再次誘導緩解治療,否則容易導致骨髓復發。
