S蛋白簡介
S蛋白又稱玻璃連結蛋白,是血清中的一種單鏈糖蛋白,分子量為83kDa。S蛋白可與C5b67複合物結合,阻止其插入細胞膜。S蛋白還可抑制C9聚合形成孔道,從而起到保護細胞免遭補體損害的作用。若C5b67或C5b678結合2~3個S蛋白,則易被溶解。
S蛋白主要由肝細胞合成,在組織內分布和纖維粘連蛋白有相當的重疊,但分子結構與纖維粘連蛋白完全不同。S蛋白有兩種構型存在,一種為單鏈,分子量為75kD,另一種是雙鏈,分子量分別為65kD和10kD。其生理功能有多種,如參與血栓形成、纖溶過程、補體系統的調節、炎症反應以及細胞功能的調節等。
S蛋白作為一種多功能黏附糖蛋白,主要通過與受體結合後參與凝血功能和形成補體複合物,發揮其黏附功能。除具有黏附蛋白的一些共性外,由於其體內分布特點、多個結構功能區域及互變的分子結構,使S蛋白成為止血過程中一種新的調節分子。
S蛋白通過促進血管內皮細胞、血小板與內皮下基質的黏附,參與保持血管壁完整性及血小板的黏附、聚集。位於內皮下基質中的s蛋白通過其分子的精氨醯一甘氨醯一天冬氨酸短肽與細胞表面特定的整合素相結合,促進細胞與基質的結合。與止血有關的細胞,如巨核細胞、血小板。內皮細胞上的整合素主要是S蛋白受體,屬於整合素超家族中的β亞家族。
在抗凝系統中,各種絲氨酸蛋白酶抑制劑和肝素起主要作用。S蛋白能抑制以絲氨酸為活性中心的凝血因子的活性,如凝血酶X、XⅠa、XⅡa、纖溶酶等,而以肝素為代表的糖胺多糖是絲氨酸蛋白酶抑制劑的輔助因子,能加速絲氨酸蛋白酶抑制劑對凝血因子的抑制。S蛋白能與肝素結合,保護凝血酶不致被快速滅活。
另外S蛋白還能直接與纖溶酶原結合,結合位置在肝素結合區,但肝素對兩者的結合幾乎無影響,S蛋白與纖溶酶原結合,能夠推遲甚至抑制纖維蛋白所啟動的纖溶酶原激活及纖溶酶形成,由此可見,S蛋白是凝血和纖溶兩大系統的一種新的聯繫分子 。
血清S蛋白
血清S蛋白是一種在體外調節細胞黏附的血清擴散因子。它的基因存在於人類第17q染色體。相對分子質量為70000,並含有基質血漿蛋白及細菌的多個結合位點。血清S蛋白在肝臟中產生,少量由間充質細胞合成。在礦化基質中血清S蛋白的含量很少,它可能來源於循環或內分泌系統。
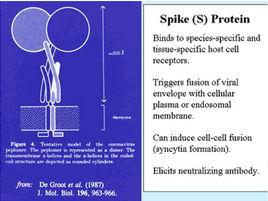
冠狀病毒
冠狀病毒具有很廣的宿主範圍,可感染多種哺乳動物和鳥類,能夠引起呼吸系統、腸道,肝臟和中樞神經系統等部位的疾病。冠狀病毒能夠引起人和家禽的上呼吸道感染;豬、牛冠狀病毒能夠引起腸道感染;小鼠肝炎病毒中部分毒株可引發肝炎,其他毒株可引發腸道疾病或神經系統疾病。
冠狀病毒宿主範圍和組織嗜性的變化很大程度上是因為S蛋白的多樣性。S蛋白是一類很大的糖蛋白,N端(S1)和C端(S2)具有截然不同功能的結構域。一般認為S1超變區與冠狀病毒的趨向性有密切關係。
不同MHV毒株的比較研究表明S蛋白為組織嗜性和致病性的中介。核酸序列也表明病毒毒力的變化與spike基因的差異密切相關,並已經被靶向RNA重組技術證實。
在沒有任何S蛋白結構數據的情況下,理解S蛋白與致病性之間的關係是非常困難的。人們僅僅知道S1可非依賴的與細胞受體結合,S2部分為介導膜融合所必需。S1片段變異性較強,S2片段在某些變異體中也會變化,因此,冠狀病毒致病性的完整理解需要將受體識別和膜融合兩個過程綜合考慮。
冠狀病毒受體的分布與致病性有密切聯繫。在這點上,S蛋白顯示出一定的受體特異性。在沒有S蛋白及其受體的詳細結構數據的情況下,對病毒侵入起始階段的研究主要依賴於對S蛋白及其受體結合所需的蛋白質局部片斷的分析 。
不同S蛋白一受體相互作用的精確親和力還沒有確定,但此數據對冠狀病毒致病性和進化的研究非常重要。MHV受體屬於癌胚抗原黏附分子多向性家族(pleiotropic family),這是一個包含很廣泛的分子家族,在多種細胞中都有表達。CEACAM的家族成員在組織分布和與S蛋白結合能力方面有很大不同。不僅如此,具有不同親合能力的受體在不同的組織和機體的不同生長階段表達也不同,所以病毒對於宿主的致病性會呈現出時間和空間上的差異。含有“N”結構域的多受體的存在也可能與MHV進化有關。實驗觀察到,MHV在持續感染組織培養細胞後可以感染人、鼠、貓和猴的細胞,據此可以推測病毒可以通過自身變異與這些物種的CEACAM受體更加有效的結合。
親和力數據對於理解病毒對宿主細胞的入侵過程是必需的,因為病毒與受體結合過程中釋放的自由能可以引發病毒進入細胞的下一個步驟S蛋白介導的膜融合。具有更高親和力的受體使融合反應更加有效,這就強調了利用s蛋白一受體複合物構象變化來解釋細胞融合的重要性。在此方面,對MHV S蛋白的研究比較多。MHV JHM的S蛋白在內質網中合成,翻譯後被切割成外圍S1和跨膜S2兩個亞基。S1部分在體外可以同受體結合。S2可能含有一個跟融合有關的結構域,具體位置不明。S2具有三段兩性的七價重複序(amphipathic heptad repeatsequence),每個區域都有形成捲曲螺旋結構的傾向。因此我們推測,S1與受體結合釋放的能量使S2融合肽暴露出來,三段預測的螺旋區域(helical region)變為捲曲結構(coiled—coil structure),進而使病毒外膜同靶細胞外膜充分接近。
MHV JHM毒株S蛋白的行為表明可能存在另外一種融合機制。MHV JHMspike可以在缺少CEACAM受體的情況下介導病毒一細胞之間的膜融合。近來發現這種機制需要特定的酸鹼度。S蛋白在酸性的高爾基體內腔時,會保持一種穩定的複合體狀態。然而一旦出現於細胞膜上時,S蛋白的複合物就會進入一個升高的pH值環境,並很快被分解成S1、S2兩部分,其中一部分就介導不依靠受體的融合。當JHM在組織培養液中繁殖時,很多病毒的spike基因發生了變異。變異之後的S蛋白S1與S2之間的結合能力更強。從而使複合物結合更加穩定,在沒有同CEACAM結合的情況下不能跨越融合所需要的能壘。對MHV JHM毒株的研究表明,在鼠(CNS中樞神經系統)中很少能探測到CEACAM受體,因此冠狀病毒S蛋白在CNS中的快速擴散不需同特定受體結合就可變成有融合活性的構象。另一方面,S蛋白的不穩定性是冠狀病毒在組織培養中的一大劣勢,穩定突變的spike會被選擇。MHV JHM突變體S蛋白在CNS中不能變成一種具有融合活性的構象可以用來解釋其毒性的減弱。MHV JHM類病毒S蛋白感染CNS的行為可幫助我們理解病毒感染機制的早期事件 。
臨床意義
S蛋白來源於肝臟,是評價肝臟合成功能的指標。各種肝病患者血漿S蛋白水平均降低,尤以肝細胞性肝病和肝硬化患者降低為明顯,並隨肝硬化嚴重程度呈進行性降低。
常見S蛋白降低的疾病:
1、肝炎、肝硬化、肝功能衰竭、肝癌等。
2、彌散性血管內凝血患者的血漿S蛋白水平常明顯降低,合併有肝衰竭者下降更為顯著。
3、腎病、系統性紅斑狼瘡等 。